
5.会用结构示意图表示原子或离子结构
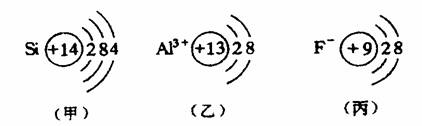
(1)原子中:核电荷数:核外电子数,如下图(甲)所示结构示意图。
(2)阳离子:核电荷数>核外电子数,如下图(乙)所示结构示意图。
(3)阴离子:核电荷数<核外电子数,如下图(丙)所示结构示意图。
4.原子核外电子分层排布的一般规律
在含有多个电子的原子里,电子依能量的不同是分层排布的,其主要规律是:
(1)核外电子总是尽先排布在能量较低的电子层,然后由里向外,依次排布在能量逐步升高的电子层(能量最低原理)。
(2)原子核外各电子层最多容纳2n2个电子。
(3)原子最外层电子数目不能超过8个(K层为最外层时不能超过2个电子)。
(4)次外层电子数目不能超过18个(K层为次外层时不能超过2个),倒数第三层电子数目不能超过32个。
3.电子层的表示方法
|
电子层数 |
|
|
|
|
|
|
|
|
符号 |
K |
L |
M |
N |
O |
P |
Q |
|
最多容纳电子数(2n2) |
2 |
8 |
18 |
32 |
……2n2 |
||
|
能量大小 |
K<L,M<N<O<P<Q |
2.电子云
(1)核外电子运动的特点:①质量很小,带负电荷;②运动的空间范围小(直径约为10-10 m);③高速运动。
(2)电子云的概念:原子核外电子绕核高速运动是没有确定的轨道的,就好像一团“带负电荷的云雾”笼罩在原子核周围,这种“带负电荷的云雾”称之为电子云。电子云密集(单位体积内小黑点多)的地方,电子出现的机会多;反之,电子云稀疏(单位体积内小黑点少)的地方,电子出现的机会少。
1. 原子的组成和三种微粒间的关系

A X的含义:代表一个质量数为A、质子数为Z的原子。
质量数(A);质子数(Z)+中子数(N)。
核电荷数:元素的原子序数;质子数:核外电子数。
4.粒子半径大小比较。
试题大多以选择题形式出现,模式也较为稳定。由于原子结构的发现源于物理学中α粒子的运动实验,无疑,原子结构成了理化学科间综合的素材。预计这一知识会成为“3+X”综合测试命题的依据。
3.已知同位素质量数和平均相对原子质量,求同位素的原子个数比;
2.分子、原子、离子核外电子数的比较;
1.关于原子的组成及各粒子的关系;
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com