
2.根据非金属活动性顺序来判断:
一般来说,越活泼的非金属,得到电子还原成非金属阴离子越容易,其阴离子失电子氧化成单质越难,还原性越弱。
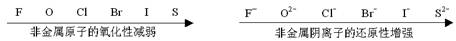
第5讲 氧化还原反应
★考情直播
考纲解读
|
考纲内容 |
能力要求 |
考向定位 |
|
了解氧化还原反应的概念及概念间的相互关系。 |
能正确理解氧化还原反应的概念及概念间的相互关系;能用单、双线桥正确表示氧化还原反应中电子转移的方向和数目;能正确判断氧化剂、还原剂、氧化产物、还原产物。 |
氧化还原反应是高中化学的基础知识,它贯穿与高中化学的始终,是高考化学的高频考点之一。氧化还原的应用主要集中在氧化性、还原性的强弱比较,氧化还原反应中电子转移的方向和数目的表示,以电子转移为核心的有关计算等等。从历年高考试题来看,其考查方式灵活多样,可以独立命题考查,也可以贯穿于填空、推断、实验、计算等各类试题之中,正确理解氧化还原反应的概念和规律,灵活运用电子转移守恒是掌握本讲知识的关键。 |
|
了解氧化还原反应的本质是电子的转移,了解常见的氧化还原反应。 |
能正确比较氧化剂的氧化性、还原剂的还原性强弱;掌握氧化还原反应方程式的配平方法;灵活运用电子转移守恒法进行氧化还原反应的相关计算。 |
考点整合
考点一 氧化还原反应、氧化剂、还原剂、氧化产物、还原产物
|
概念 |
定义 |
注意点 |
|
氧化反应 |
物质失去电子的反应 |
物质失去电子的外部表现为化合价的升高 |
|
还原反应 |
物质得到电子的反应 |
物质得到电子的外部表现为化合价的降低 |
|
被氧化 |
元素失去电子的过程 |
元素失去电子的外部表现为化合价的升高 |
|
被还原 |
元素得到电子的过程 |
元素得到电子的外部表现为化合价的降低 |
|
氧化产物 |
通过发生氧化反应所得的生成物 |
氧化还原反应中,氧化产物、还原产物可以是同一种产物,也可以是不同产物,还可以是两种或两种以上的产物。如反应4FeS2+11O2=2Fe2O3+8SO2中,Fe2O3和SO2均既为氧化产物,又为还原产物。 |
|
还原产物 |
通过发生还原反应所得的生成物 |
|
|
氧化剂 |
得到电子的反应物 |
常见氧化剂:(1)活泼的非金属单质;如卤素单质(X2)、O2、S等(2)高价金属阳离子;如Fe3+、Cu2+等(3)高价或较高价含氧化合物;如MnO2、浓H2SO4、HNO3、KMnO4等(4)过氧化物;如Na2O2、H2O2等 |
|
还原剂 |
失去电子的反应物 |
常见还原剂:①活泼或较活泼的金属;如K、Na、Zn、Fe等②一些非金属单质;如H2、C、Si等③较低态的化合物;CO、SO2、H2S、Na2SO3、FeSO4 |
|
氧化性 |
得到电子的能力 |
物质的氧化性、还原性的强弱与其得失电子能力有关,与得失电子的数目无关。 |
|
还原性 |
失去电子的能力 |
[例1](2008·茂名一模)金属钛(Ti)性能优越,被称为继铁、铝制后的“第三金属”。工业上以金红石为原料制取Ti的反应为:
aTiO2 + bCl2 + cC 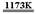 aTiCl4 + cCO ……反应①
aTiCl4 + cCO ……反应①
TiCl4 +2Mg 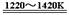 Ti + 2MgCl2
……反应②
Ti + 2MgCl2
……反应②
关于反应①、②的分析不正确的是( )
①TiCl4在反应①中是还原产物,在反应②中是氧化剂;
②C、Mg在反应中均为还原剂,被还原;
③在反应①、②中Mg的还原性大于C,C的还原性大于TiCl4;
④a=1,b=c=2;
⑤每生成19.2 g Ti,反应①、②中共转移4.8 mol e-。
A.①②④ B.②③④ C.③④ D.②⑤
[解析]②中C、Mg在反应中均为还原剂,被氧化;经计算知⑤中每生成19.2 g Ti,反应①、②中共转移3.2 mol e-
[答案]D
[知识规律]
还原性 化合价升高 弱氧化性
|
 ↑
↑
|
|
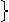
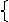

 还原剂 氧化反应
氧化产物
还原剂 氧化反应
氧化产物
|

 氧化剂 还原反应
还原产物
氧化剂 还原反应
还原产物
 ↓
↓
 ↓
↓
氧化性 化合价降低 弱还原性
考点二 物质的氧化性强弱、还原性强弱的比较。
氧化性→得电子性,得到电子越容易→氧化性越强
还原性→失电子性,失去电子越容易→还原性越强
由此,金属原子因其最外层电子数较少,通常都容易失去电子,表现出还原性,所以,一般来说,金属性也就是还原性;非金属原子因其最外层电子数较多,通常都容易得到电子,表现出氧化性,所以,一般来说,非金属性也就是氧化性。
1.根据金属活动性顺序来判断:
一般来说,越活泼的金属,失电子氧化成金属阳离子越容易,其阳离子得电子还原成金属单质越难,氧化性越弱;反之,越不活泼的金属,失电子氧化成金属阳离子越难,其阳离子得电子还原成金属单质越容易,氧化性越强。

19.(2008·江西九校联考)为了防治环境污染并对尾气进行综合利用,某硫酸厂用氨水吸收尾气中的 ,再向吸收液中加入浓硫酸,以制取高浓度的
,再向吸收液中加入浓硫酸,以制取高浓度的 及
及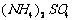 和
和 固体。为测定上述
固体。为测定上述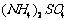 和
和 固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[
固体混合物的组成,现称取该样品四份,分别加入相同浓度的NaOH溶液各40.00mL,加热至120℃左右,使氨气全部逸出[ 和
和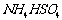 的分解温度均高于200℃],测得有关实验数据如下(标准状况):
的分解温度均高于200℃],测得有关实验数据如下(标准状况):
|
实验序号 |
样品的质量/g |
NaOH 溶液的体积/Ml |
氨气的体积/L |
|
Ⅰ |
7.4 |
40.00 |
1.68 |
|
Ⅱ |
14.8 |
40.00 |
3.36 |
|
Ⅲ |
22.2 |
40.00 |
1.12 |
|
Ⅳ |
37.0 |
40.00 |
0.00 |
(1)实验过程中有关反应的离子方程式为_______________________;
(2)由Ⅰ组数据直接推测:标准状况下3.7g样品进行同样实验时,生成氨气的体积为__________________L;
(3)试计算该混合物 和
和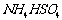 的物质的量之比为
。
的物质的量之比为
。
(4)欲计算该NaOH溶液的物质的量浓度应选择第____________组数据,由此求得NaOH溶液的物质的量浓度为______________。
[答案](1)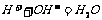 ,
,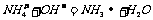 (2)0.84
(2)0.84
(3)设样品中 物质的量为x,
物质的量为x,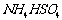 的物质的量为y,则:
的物质的量为y,则:
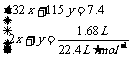 解得
解得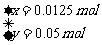
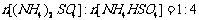
(4)Ⅲ;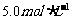
18.(2008·惠州一模)在硫酸铝、硫酸钾和明矾的混合溶液中,如果c(SO42-)=0.2 mol/L,当加入等体积、某浓度的KOH溶液时,恰好沉淀完全,则所得溶液中K + 的物质的量浓度是( )
A.0.2 mol/L B.0.25 mol/L C.0.1 mol/L D.0.225 mol/L
[解析]由题意知,最后所得的溶液为K2SO4溶液,又因为加入的KOH溶液的体积与原溶液的体积相等,故最后所得的溶液中K+ 浓度为0.2 mol/L。
[答案]A
17.(2008·黄冈中学)质量分数为a的某物质的溶液mg与质量分数为b的该物质的溶液ng混合后,蒸发掉pg水,得到的溶液每毫升质量为qg,物质的量浓度为c。则溶质的相对分子质量为( )
A.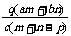 B.
B.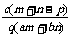 C.
C.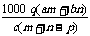 D.
D.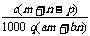
[解析]溶质的质量为(am+bn)g,溶液的体积为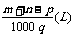 ,
,
则: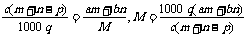
[答案]C
16.(2005·广东)某研究性学习小组欲用化学方法测量一个不规则容器的体积。把35.1gNaCl放入500mL烧杯中,加入150mL蒸馏水。待NaCl完全溶解后,将溶液全部转移到容器中,用蒸馏水稀释到完全充满容器。从中取出溶液100mL,该溶液恰好与20mL 0.100mol/L AgNO3溶液完全反应。试计算该容器的体积。
[解析]AgNO3+NaCl=AgCl↓+NaNO3
n(NaCl)=n(AgNO3)=0.100 mol·L-1×0.02L=0.002mol
m(NaCl)=0.002mol×58.5 g·mol-1=0.117 g
V(容器)=100mL×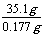 =30000mL=30L
=30000mL=30L
[答案]30L
能力提高训练
15.(2007· 深圳模拟)标准状况下,1体积水吸收500体积NH3后,所得氨水密度为0.9g·cm-3,求氨水中溶质的质量分数和氨水的物质的量浓度各为多少?
[解析]设标准状况下,1L水溶解500LNH3,则:
氨水中溶质的质量分数为:ω=m(NH3)/[m(NH3) + m(H2O)]×100%
=(17g·mol-1×500L/22.4L·mol-1)/(17g·mol-1×500L/22.4L·mol-1+1g·mL-1×1000mL)×100% =27.5%;
故:氨水的物质的量浓度为:c=ρg·mL-1×1000mL·L-1×ω/Mg·mol-1
=0.9 g·mL-1×1000 mL·L-1×27.5%/17g·mol-1
=14.6 mol·L-1。
[答案]溶质的质量分数为27.5%;氨水的物质的量浓度为14.6 mol·L-1。
14.有一在空气中暴露过的KOH固体,经分析知其内含水7.12%,K2CO32.88%,KOH90%,若将此样品1g加入到46.00ml的1mol·L-1盐酸中,过量的酸再用1.07mol·L-1KOH溶液中和,蒸发中和后的溶液可得固体 克。
[解析]此题中发生的反应很多,但仔细分析可知:蒸发溶液后所得固体为氯化钾,其Cl-全部来自于盐酸中的Cl-,在整个过程中Cl-守恒。 即n(KCl)= n(HCl),故有:
m(KCl)=0.046L×1 mol·L-1×74.5 g · mol-1=3.427 g
[答案]3.427 g
13.(2008·北大附中)将a%的酒精和(100-a)%的乙醇溶液等体积混和后所得乙醇溶液的质量分数可能为( )
A.大于50% B.小于50% C.小于或等于50% D.大于或等于50%
[解析]混合有两种可能:一是a=50等浓度混合,二是a≠50,100-a<50(或a<50,100-a>50),由于乙醇的密度随浓度的增大而减小,即浓度小于50%的乙醇质量大,依中间法,当a>50,混合后质量分数在50-(100-a)之间,即<50%。
[答案]C
12.(2008·黄冈中学)为检验某病人血液中的含钙量,现取10mL血液样品稀释后用草酸铵[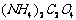 ]处理成草酸钙沉淀,将此沉淀溶于过量的稀
]处理成草酸钙沉淀,将此沉淀溶于过量的稀 中,然后用
中,然后用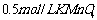 溶液(生成
溶液(生成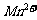 、
、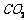 、
、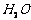 )恰好消耗1.6mL,则该病人血液中含钙量为( )
)恰好消耗1.6mL,则该病人血液中含钙量为( )
A.2.4 g/L B.8 g/L C.6 g/L D.12 g/L
[解析]由反应
5 2
X 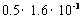 解得:
解得: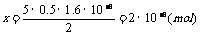
故含钙量为: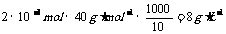
[答案]B
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com