
33、(18分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
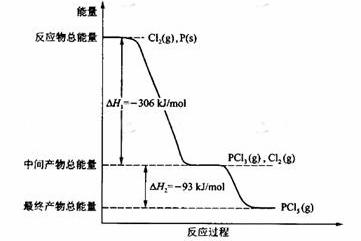
根据上图回答下列问题:
(1)P和Cl2反应生成PCl3的热化学方程式是: ;
(2)PCl5分解成PCl3和Cl2的热化学方程式是: ;
上述分解反应是一个可逆反应。温度T1时,在密闭容器中加入0.80mol PCl5,反应达平衡时PCl5还剩0.60 mol,其分解率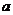 1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为
1等于
;若反应温度由T1升高到T2,平衡时PCl5的分解率为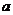 2,
2,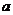 2
2
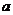 1(填“大于”、“小于”或“等于”);
1(填“大于”、“小于”或“等于”);
(3)工业上制备PCl5通常分两步进行,现将P和Cl2反应生成中间产物PCl3,然后降温,再和Cl2反应生成PCl5。原因是 ;
(4)P和Cl2分两步反应生成1 mol PCl5的△H 3= ,P和Cl2一步反应生成1 mol PCl5的△H 4 △H 3(填“大于”、“小于”或“等于”)。
(5)PCl5与足量水充分反应,最终生成两种酸,其化学方程式是: 。
32、(16分)化合物KxFe(C2O4)y·3H2O(Fe为+3价)是一种光敏感材料,实验室可以用如下方法制备这种材料并测定其组成。
I.制备:

⑴结晶时应将饱和溶液在黑暗处等待晶体的析出,这样操作的原因是:__________________。
⑵操作Ⅲ的名称是____________________。
Ⅱ.组成测定:称取一定质量实验所得晶体置于锥形瓶中,加足量蒸馏水和稀H2SO4.将C2O42-完全转化为H2C2O4,用0.10mol·L-1KMnO4溶液进行滴定,消耗KMnO4溶液24.00mL时恰好反应;再加入适量的还原剂,将Fe3+完全转化为Fe2+,用KMnO4溶液继续滴定,当Fe2+完全氧化时,用去KMnO4溶液4.00mL。相关反应如下:2KMnO4 + 5H2C2O4 + 3H2SO4 = 2MnSO4 + K2SO4 + 10CO2↑ + 8H2O
MnO4- + 5Fe2+ + 8H+ = Mn2+ + 5Fe3+ + 4H2O
⑶配制l00mL 0.10mol·L-1KMnO4溶液及上述滴定实验中所需的玻璃仪器除烧杯、玻璃棒、胶头滴管、量筒、锥形瓶外还有 和 (写名称)。两个滴定中到达终点时溶液颜色为
色,且30秒内不变色。
⑷通过计算,该化合物KxFe(C2O4)y·3H2O中的x= 。
31、(14分)已知X、Y、Z、W四种元素是元素周期表中连续三个短周期的元素,且原子序数依次增大。X、W同主族,Y、Z为同周期的相邻元素。W原子的核外电子数等于Y、Z原子最外层电子数之和。Y的氢化物分子中有3个共价键。Z原子最外层电子数是次外层电子数的3倍,试推断:(1)X、Z二种元素的元素符号:X_________;Z__________
(2)由以上元素中的两种元素组成的能溶于水且水溶液显碱性的化合物的电子式分别为______、_____、_____
(3)由X、Y、Z所形成的常见离子化合物是___________,它与W的最高价氧化物的水化物的浓溶液加热时反应的离子方程式__________
 (4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
(4)在由X、Y、Z、W四种元素形成的常见化合物或单质中,不能形成的晶体类型是________
30、(16分)(1)元素周期表是20世纪科学技术发展的重要理论依据之一,是我们学习化学的重要工具。假设NH4+是“元素”NH4的阳离子,则“元素” NH4在周期表中的位置应该是第 周期第 族;“元素” NH4的单质常温常压下应为 (填“固”、“液”或“气”)体;熔点 (填“高”或“低”) ; (填“能”或“不能”)导电;NH4的碳酸盐应 (填“易”或“不易”)溶于水。
(2)氯、溴、碘同属于周期表中的VII A族,在上个世纪,人们很早就制得高碘酸及其盐,但得不到含+7价溴的化合物,1968年,化学家用发现不久的XeF2和KBrO3首先制得纯净的KBrO4晶体。
①高碘酸盐(IO65-)能在酸性条件下将Mn2+氧化为MnO4-(本身被还原成I03-),其反应平稳而迅速,写出离子反应方程式: 。
②在25℃,已知pH=2的高碘酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显酸性;0.01mol·L-1的碘酸或高锰酸溶液与pH=12的NaOH溶液等体积混合,所得混合液显中性。则高碘酸是 ;高锰酸是 (填“强酸”或“弱酸”)。
③写出XeF2和含KOH、KBrO3的水溶液反应得到KBrO4的离子方程式 。
29、(16分)2005年3月,广东省质量技
术监督局从亨氏美味源食品有限公
 司生产的272箱美味源金唛桂林辣椒酱中检验出苏丹红。报道中提到苏丹红是一种人工色素(工业染料),它在人体内代谢生成相应的胺类。科研人员以某动物为实验材料,用“动物细胞培养技术”对其毒害性进行了检测。
司生产的272箱美味源金唛桂林辣椒酱中检验出苏丹红。报道中提到苏丹红是一种人工色素(工业染料),它在人体内代谢生成相应的胺类。科研人员以某动物为实验材料,用“动物细胞培养技术”对其毒害性进行了检测。
(1)若实验小鼠为雌性,过程①表示生殖细胞形成的过程,甲图中有________个染色单体,形成的子细胞名称是__________,该动物体细胞中有 对染色体。
(2)用过程②检测有毒物质毒性的指标是变异细胞占全部培养细胞的百分数。请完善检测苏丹红毒性的实验。主要实验步骤:
第一步:取大小相同的六只培养瓶编号为1-6,分别加入等量相同的培养液和小鼠细胞。
第二步:向1号培养瓶加 ,向2-6号培养瓶中加 。
第三步:培养一段时间后,取样制成临时制片,观察记录 。
28.(20分)
雄鸟的性染色体组成是ZZ,雌鸟的性染色体组成是ZW。某种鸟羽毛的颜色由常染色体基因(A、a)和伴染色体基因(ZB、Zb)共同决定,其基因型与表现型的对应关系见下表。请回答下列问题。
|
基因组合 |
A不存在,不管B存在与否(aa Z-Z- 或aa Z- W) |
A存在,B不存在 (A ZbZb或A ZbW) |
A和B同时存在 (A ZBZ- 或A ZBW |
|
羽毛颜色 |
白色 |
灰色 |
黑色 |
(1)黑鸟的基因型有 种,灰鸟的基因型有 种。
(2)基因型纯合的灰雄鸟与杂合的黑雌鸟交配,子代中雄鸟的羽色是 ,此鸟的羽色是 。
(3)两只黑鸟交配,子代羽毛只有黑色和白色,则母体的基因型为 ,父本的基因型为 。
(4)一只黑雄鸟与一只灰雌鸟交配,子代羽毛有黑色、灰色和白色,则母本的基因型为 ,父本的基因型为 ,黑色、灰色和白色子代的理论分离比为 。
27.(16分)多指为一种常染色体显性遗传病,受P基因控制;色盲是一种X染色体的隐性基因控制的遗传病,受b基因控制,分析下列遗传系谱,回答问题:
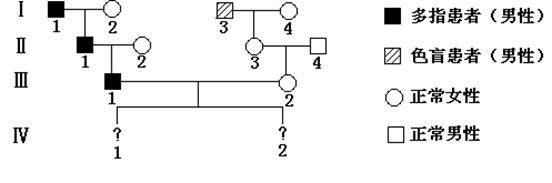
⑴Ⅲ-1产生的精子类型分别是 ______________;
⑵Ⅲ-2的基因型是 ___ ______,
⑶如果Ⅳ-1是一个男孩,此男孩只患多指不患色盲的概率为 ;
⑷如果Ⅳ-2是一个女孩,则她两病都不患的概率为 。
26.(12分)棉花的纤维有白色的,也有紫色的;植株有抗虫的也有不抗虫的。为了鉴别有关性状的显隐关系,用紫色不抗虫植株分别与白色抗虫植株a、b进行杂交,结果如下表。(假定控制两对性状的基因独立遗传;颜色和抗虫与否的基因可分别用A、a和B、b表示),请回答:
|
组合序号 |
杂交组合类型 |
子代的表现型和植株数目 |
|
|
紫色不抗虫 |
白色不抗虫 |
||
|
1 |
紫色不抗虫×白色抗虫a |
210 |
208 |
|
2 |
紫色不抗虫×白色抗虫b |
0 |
280 |
(1)上述两对性状中, 和 是显性性状。
(2)作出上述判断所运用的遗传定律是 。
(3)亲本中紫色不抗虫、白色抗虫a、白色抗虫b的基因型分别是 、 、 。
25.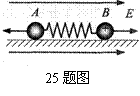 如图所示,质量分别为m1和m2的两个小球A、B,带有等量异种电荷,B带正电,A带负电,通过绝缘轻弹簧相连接,置于绝缘光滑的水平面上。当突然加一水平向右的匀强电场后,两小球A、B将由静止开始运动,在以后的运动过程中,对两个小球和弹簧组成的系统(设整个过程中不考虑电荷间库仑力的作用且弹簧不超过弹性限度),以下说法正确的是
如图所示,质量分别为m1和m2的两个小球A、B,带有等量异种电荷,B带正电,A带负电,通过绝缘轻弹簧相连接,置于绝缘光滑的水平面上。当突然加一水平向右的匀强电场后,两小球A、B将由静止开始运动,在以后的运动过程中,对两个小球和弹簧组成的系统(设整个过程中不考虑电荷间库仑力的作用且弹簧不超过弹性限度),以下说法正确的是
A.因电场力一定分别对球A和球B做正功,故系统机械能不
断增加
B. 因两个小球所受电场力等大反向,故系统机械能守恒
C.当弹簧长度达到最大值时,系统机械能最大
D.当小球所受电场力与弹簧的弹力相等时,系统动能最大
第II卷 (共182分)
24.在奥运比赛项目中,高台跳水是我国运动员的强项。质量为m的跳水运动员进入水中后受到水的阻力而做减速运动,设水对他的阻力大小恒为F,那么在他减速下降深度为h的过程中,下列说法正确的是(g为当地的重力加速度)( )
A.他的动能减少了Fh B.他的重力势能减少了mgh
C.他的机械能减少了(F-mg)h D.他的机械能减少了Fh
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com