
21、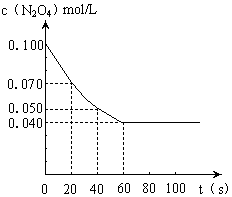 在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4
在温度为373K时,将0.100mol无色的N2O4气体放入1L抽空的密闭容器中,立刻出现红棕色,直至建立N2O4  2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
2NO2的平衡。下图是隔一定时间测定到的N2O4的浓度(纵坐标为N2O4的浓度,横坐标为时间)
(1)计算在20至40秒时间内,NO2的平均
生成速率为 mol·Lˉ1·sˉ1。
(2)该反应的化学平衡常数表达式为
。
(3)下表是不同温度下测定得到的该反应
的化学平衡常数。
|
T/ K |
323 |
373 |
|
K值 |
0.022 |
0.36 |
据此可推测该反应(生成NO2)是 反应(选填“吸热”或“放热”)
(4)若其他条件不变,反应在423K时达到平衡,请在上图中找出相应的位置,添画出此温度下的反应进程曲线。
20、化学平衡移动原理,同样也适用于其他平衡,已知在氨水中存在下列平衡.
NH3 + H2O 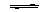 NH3·H2O
NH3·H2O
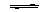 NH4+
+ OHˉ
NH4+
+ OHˉ
(1)向氨水中加入MgCl2固体时,平衡向__________移动,OHˉ的浓度__________,NH4+的浓度_____。
(2)向氨水中加入浓盐酸,平衡向___________移动,此时溶液中浓度减小的粒子有___________、___________、___________。
(3)向浓氨水中加入少量NaOH固体,平衡向______移动,此时发生的现象 __________。
19、某化学科研小组研究在其他条件不变时,改变某一条件对化学平衡的影响,得到如下变化规律(图中P表示压强,T表示温度,n表示物质的量):
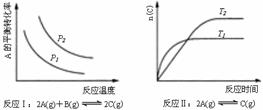
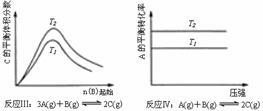
根据以上规律判断,上列结论正确的是
A.反应Ⅰ:△H>0,P2>P1 B.反应Ⅱ:△H<0,T1>T2
C.反应Ⅲ:△H>0,T2>T1;或△H<0,T2<T1 D.反应Ⅳ:△H<0,T2>T1
18.体积相同的甲、乙两个容器中,分别充有等物质的量的SO2和O2,在相同温度下发生反应:2SO2 + O2 2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.等于p% B.大于p% C.小于p% D.无法判断
17、可逆反应a A(s)+b B(g)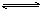 c C(g)+d D
c C(g)+d D (g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是(
(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图下列叙述正确的是(
A.达平衡后,加入催化剂则C%增大
B.达平衡后,若升温,平衡左移
C.化学方程式中b >c +d
D.达平衡后,增加A的量有利于平衡向右移动
16、在锌片和盐酸的反应中,加入如下试剂,可使生成氢气的速度变慢的是
A.硫酸铜晶体 B.水 C.氯化钡晶体 D.醋酸钾晶体
15、在N2+3H2  2NH3的平衡体系中,当分离出NH3时,下列说法正确的是
2NH3的平衡体系中,当分离出NH3时,下列说法正确的是
A.正反应速率增大 B.平衡向逆反应方向移动
C.正反应速率大于逆反应速率 D.逆反应速率先变小后变大
14、反应3Fe(s)+4H2O(g)  Fe3O4+4H2(g)
在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
Fe3O4+4H2(g)
在一可变的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是
A.增加Fe的物质的量
B.将容器的体积缩小一半
C.保持体积不变,充入Ne使体系压强增大
D.压强不变,充入Ne使容器的体积增大
13、 一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S) Ca2+(aq)+2OHˉ(aq)当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
一定温度下,石灰乳悬浊液中存在下列平衡:Ca(OH)2(S) Ca2+(aq)+2OHˉ(aq)当向一定量的石灰乳悬浊液中加入少量生石灰时,下列说法正确的是
A.溶液中Ca2+离子数目减少 B.溶液c(Ca2+)减小
C.溶液的pH不变 D.溶液中溶质的质量分数增大
12、下列事实不能用勒沙特列原理解释的是
A.开启啤酒瓶后,瓶中马上泛起大量泡沫
B.钢铁在潮湿的空气中容易生锈
C.工业合成氨时常用通过量氮气的方法提高氢气的转化率
D.工业上生产硫酸的过程中使用过量的空气以提高二氧化硫的利用率
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com