
9.已知弱电解质电离时吸热过程,试判断:下列溶液中H+浓度最大的是
A.40℃ 100 ml 0.01 mol·Lˉ1 CH3COOH
B.60℃ 10 ml 0.1 mol·Lˉ1CH3COOH
C.30℃ 50 ml 0.01 mol·Lˉ1CH3COOH
D.20℃ 1000 ml 0.1 mol·Lˉ1CH3COOH
8.下列各种酸溶液的c(H+)相同,其中物质的量浓度最大的是
A.CH3COOH B.HCl C.H2SO4 D.H3PO4
7.将c(H+)=10ˉ2 mol·Lˉ1的醋酸和盐酸溶液分别稀释100倍,稀释后两溶液的c(H+)分别为a和b,则a和b的关系为
A.a>b B.a<b C.a=b D.无法确定
6.氢离子浓度为1×10ˉ3mol·Lˉ1的醋酸溶液20ml,用0.1 mol·Lˉ1的氢氧化钠溶液10 ml恰好完全中和,则醋酸的电离度是
A.1% B.2% C.3% D.4%
5.在溶液导电性实验装置里,分别注入20ml4 mol·Lˉ1的醋酸和20ml4 mol·Lˉ1的氨水,灯光明暗程度相似,如果把这两种溶液混合后再试验,则
A.灯光明暗程度不变 B.灯光变暗
C.灯光变亮 D.灯光明暗程度变化不明显
4.在0.1 mol·Lˉ1的醋酸溶液中逐渐加入蒸馏水,随着水的加入,在一定时间内始终保持增大趋势的是
A.c(H+) B.c(CH3COOˉ)
C.c(H+)/ c(CH3COOH)的比值 D.c(CH3COOH)/ c(H+)的比值
3.在0.1 mol·Lˉ1醋酸溶液中加入少量0.1 mol·Lˉ1盐酸,下列叙述正确的是
A.CH3COOH的电离度增大,c(H+)增大
B.平衡向生成CH3COOH方向移动,c(H+)减小
C.CH3COOH的电离度减小,pH减小
D.电离平衡向CH3COOˉ.H+方向移动,pH减小
2.某一元弱酸HA在一定条件下的电离度为α。已知此溶液中有1molHA分子,则溶液中的溶质微粒的物质的量是
A.(1+2α)/(1-α) mol B.(1+α)/ αmol
C.2α/(1-α) mol D.(1+α) /(1-α) mol
1.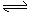 在氨水中存在NH3·H2O NH4+
+OHˉ的平衡,若要使平衡向逆方向移动,同时使c(OHˉ)增大,应加入
在氨水中存在NH3·H2O NH4+
+OHˉ的平衡,若要使平衡向逆方向移动,同时使c(OHˉ)增大,应加入
A.氯化铵固体 B.硫酸 C.NaOH固体 D.大量水
16.强.KHSO4 =K+ + H+ + SO42-;强,KHCO3= K+ + HCO3-,有气体产生,
H+ + HCO3-=H2O+CO2↑;17.略 18.小于。氨水的浓度越稀,电离程度越大。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com