
3.影响电离平衡的外界因素
(1)温度:温度升高,电离平衡向右移动,电离程度增大。
温度降低,电离平衡向左移动,电离程度减小。
(2)浓度:电解质溶液浓度越大,平衡向右移动,电离程度减小;
电解质溶液浓度越小,平衡向左移动,电离程度增大;
2.电离平衡与化学平衡比较
“等”:电离速率与离子结合成分子的速率相等。
“定”:离子、分子的浓度保持一定。
“动”:电离过程与离子结合成分子过程始终在进行。
“变”:温度、浓度等条件变化,平衡就被破坏,在新的条件下,建立新的平衡。
1.电离平衡定义
在一定条件下(如温度,浓度),当电解质分子电离成离子的速率和离子重新结合成分子的速度相等时,电离过程就达到了平衡状态,这叫做电离平衡。
3.强弱电解质与结构关系。
(1)强电解质结构:强碱,盐等离子化合物(低价金属氧化物);
强酸,极性共价化合物;
(2)弱电解质结构:弱酸,弱碱具有极性共价位的共价化合物。
2.电离方程式:
电离方程式书写也不同
(1)强电解质: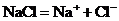
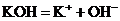
(2)弱电解质: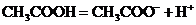
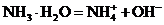
1.区分电解质强弱的依据:
电解质在溶液中“电离能力”的大小。

2.电解质导电实质,电解质溶液导电能力强弱的原因是什么?
1.定义:在水溶液中或熔融状态下,能导电的化合物叫电解质。
[思考]①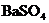 ,
,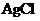 在水溶液中,不导电,它属于非电解质吗?为什么?
在水溶液中,不导电,它属于非电解质吗?为什么?
②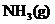 溶于水能导电,则氨气是电解质吗?为什么?
溶于水能导电,则氨气是电解质吗?为什么?
③共价化合物在液态时,能否导电?为什么?
4.扩展
难溶电解质在水溶液中存在着电离平衡。在常温下,溶液中各离子浓度以它们的系数为方次的乘积是一个常数,该常数叫溶度各(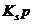 )。例如
)。例如
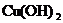

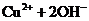
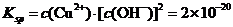
溶液中各离子浓度(加上其方次)的乘积大于、等于溶度积时出现沉淀,反之沉淀溶解。
(1)某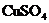 溶液中
溶液中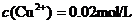 ,如需生成
,如需生成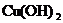 沉淀,应调整溶液的
沉淀,应调整溶液的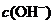 使之大于
。
使之大于
。
(2)要使0.2mol/L 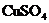 溶液中的
溶液中的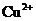 沉淀较为完全(使
沉淀较为完全(使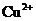 浓度降低至原来的千分之一),则应向溶液里加入
浓度降低至原来的千分之一),则应向溶液里加入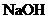 溶液,使溶液
溶液,使溶液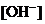 为
。
为
。
3.讨论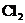 中存在哪些微粒?(包括溶剂)
中存在哪些微粒?(包括溶剂)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com