
2.若函数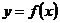 的定义域为
的定义域为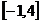 ,则函数
,则函数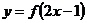 的定义域为(
)
的定义域为(
)
A. 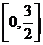 B.
B.
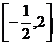 C.
C.
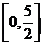 D.
D.
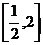
是符合题目要求的)
1.已知集合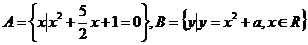 ,若
,若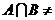 Ø ,则( )
Ø ,则( )
A. 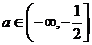 B.
B. 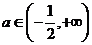 C.
C. 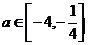 D.
D. 
20.(14分)工业炼铝是用铝土矿(主要成分是Al2O3,还有少量的Fe2O3、SiO2)提取冶炼铝的主要原料氧化铝,然后进行电解。工艺流程如下图:
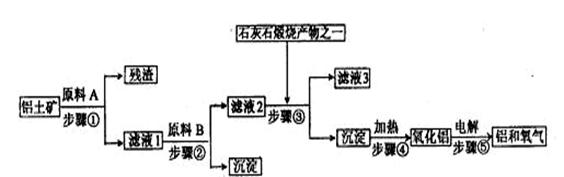
(1)滤液1中要加入稍过量的原料B,原料B的化学式是 。写出步骤②有关反应的离子方程式 、 。
(2)滤液3中溶质的主要成份是________(填化学式),写出该溶液的一种用途 。
(3)如果省去步骤①,即溶解铝土矿从直接加入原料B开始,则最终会对氧化铝的生成有什么影响? 。
(4)铝粉与三氧化二铁粉末在引燃剂作用下常用来焊接钢轨,主要是利用了该反应是 ,而且该反应焊接速度快、设备简易,适于野外作业。
(5)步骤⑤是在铝电解槽中进行,电解槽的两极材料均用石墨,其中 极的材料随反应的进行需要不断补充,为什么?
 野寨中学2011届高三第二次月考
野寨中学2011届高三第二次月考
10.0 mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是 。
②b中反应所产生的I2的物质的量是 mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_________________mg/kg。
19(12分)某研究性学习小组在网上收集到如下信息:钾、钙、钠、镁等活泼金属都能在CO2气体中燃烧。他们对钠在CO2气体中燃烧后的产物中的白色物质进行了如下探究:
[实验]将燃烧的钠迅速伸入到盛有装满CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质。
(1)通过钠在CO2气体中燃烧的实验,你认为燃烧的条件是 。
(2)燃烧的本质是 。
(3)2010年8月初发生的俄罗斯森林大火有比伦敦市还要大的面积。控制森林火灾是世界性难题。根据燃烧的条件,请你解释为什么设置森林防火隔离带能有效阻止森林火灾的蔓延? 。
[提出假设]
假设1:白色物质是Na2O。
假设2:白色物质是Na2CO3。
假设3:白色物质是Na2O和Na2CO3的混合物。
[设计实验方案.验证假设]该小组对燃烧后的白色产物进行如下探究:
|
实验方案 |
实验操作 |
实验现象 |
结论 |
|
方案1 |
取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入无色酚酞试液 |
溶液变成红色 |
白色物质为Na2O |
|
方案2 |
①取少量白色物质于试管中,加入适量水,振荡,样品全部溶于水,向其中加入过量的CaCl2溶液 |
出现白色沉淀 |
|
|
②静置片刻,取上层清液于试管中,滴加无色酚酞试液 |
无明显现象 |
[思考与交流]
(4)甲同学认为方案1得到的结论不正确,其理由是 。
(5)乙同学认为方案2得到的结论正确,白色物质为 。
(6)通过方案1和方案2的实验,你认为上述三个假设中, 成立。你的理由是 。
(7)钠在二氧化碳中燃烧的化学方程式为 。
(8)丙同学认为白色物质有可能是氢氧化钠。你是否同意丙同学的观点,并简述理由: 。
17.(14分)(Ⅰ)有一包白色粉末,可能含有NaHSO4 KHCO3 Ba(NO3)2 CaCl2 NaNO3 MgSO4 中的一种或几种。
(1)取少量粉末投入水中,既有气体又有沉淀产生;
(2)过滤,取少量滤液,加入AgNO3溶液,无沉淀产生;
(3)再取少量滤液,加入NaOH溶液,也无沉淀产生。
推断白色粉末中一定有_______ ,一定没有_______,不能肯定有没有的是
________。
(Ⅱ)现有A、B、C、D、E五种盐溶液,分别由K+、NH4+、Ag+、Ba2+ 、 Al3+、Cl-、Br-、CO32-、SO42-、NO3-中的阳离子与阴离子各一种组成(五种盐所含阴、阳离子各不相同)。
已知:①A+B→白↓;②A+C→白↓;③A+D→白↓;④B+C+H2O→白↓+气体;⑤A的溶液呈中性;⑥B的溶液中c(OH-)>c(H+);⑦C、D、E三种溶液的pH<7.根据以上事实,回答下列问题:
⑴写出化学式:C D E
⑵写出④的离子方程式:
18(12分)哈尔滨市场销售的某种食用精制盐包装袋上有如下说明:
|
产品标准 |
GB5461 |
|
产品等级 |
一级 |
|
配料 |
食盐、碘酸钾、抗结剂 |
|
碘含量(以I计) |
20-50 mg/kg |
|
分装日期 |
|
|
分装企业 |
|
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处):
___KIO3+___KI+___H2SO4 =___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是 。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是_________________________________。
(3)已知:I2+2S2O32 - = 2I-+S4O62 -。某学生测定食用精制盐的碘含量,其步骤为:
a.准确称取w g食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉溶液为指示剂,逐滴加入物质的量浓度为2.0×10-3 mol/L的Na2S2O3溶液
11.某溶液中大量存在以下五种离子:NO、SO、Fe3+、H+、M,其物质的量之比为n(NO)∶n(SO)∶n(Fe3+)∶n(H+)∶n(M)=2∶3∶1∶3∶1,则M可能为 ( )
A.Fe2+ B.Mg2+ C.CO D.Ba2+
12下列实验能达到预期目的是( )
A.向某无色液中加入BaCl2溶液产生不溶于稀HNO3的白色沉淀,说明原溶液中一定有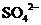
B.向某无色溶液中加入盐酸,有无色无味的气体产生,则说明原溶液中一定有CO32-
C.向某溶液中滴加KSCN溶液,溶液不变红,再滴加氯水,溶液变红,则说明有Fe2+
D.将淀粉溶液和食盐溶液混合装入半透膜,浸入纯水中,过一段时间,取半透膜内的液体滴入碘水呈蓝色,说明利用渗析可提纯胶体
13将51.2gCu完全溶于适量浓硝酸中,在标况下收集到氮的氧化物(含NO、N2O4、NO2)的混合气体共17.92 L,这些气体恰好能被400 mL 2.5 mol/LNaOH溶液完全吸收,溶液中生成NaNO3和NaNO2,则原混合气体中NO的物质的量为 ( )
A.0.3 mol B.0.4 mol C.0.5 mol D.0.6 mol
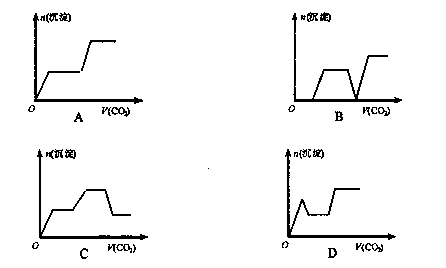
14将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为(已知Ba(AlO2):可溶)( )
15合金是指两种或两种以上的金属(或金属与非金属)熔合而成的具有金属特性的物质。分析下表中的数据,不能形成合金的是( )
|
|
Na |
Cu |
Al |
Fe |
|
熔点/℃ |
97.8 |
1083 |
660 |
1535 |
|
沸点/℃ |
883 |
2567 |
2467 |
2750 |
A.Cu和Al B.Fe和Cu C.Cu和Na D.Al和Na
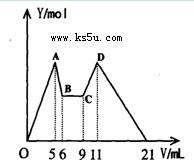 16在氯化铝和氯化镁的混合溶液中(此溶液的体积忽略不计),向其中滴加 a mLC1mol·L-1 NaOH之后,改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示。则所加入NaOH溶液的体积为( )
16在氯化铝和氯化镁的混合溶液中(此溶液的体积忽略不计),向其中滴加 a mLC1mol·L-1 NaOH之后,改成滴加C2mol·L-1HCl,所得沉淀Y(mol)与试剂总体积V(mL)间的关系如右图所示。则所加入NaOH溶液的体积为( )
A . 9ml B. 7.5ml
C. 7ml D. 6ml
第Ⅱ卷(52分)
10. 在25℃,101Kpa下由HCHO(g)、H2和CH4组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与足量的氧气充分反应后的产物(水为气态)通过足量的Na202粉末,使Na202粉末增重的质量为 ( )
在25℃,101Kpa下由HCHO(g)、H2和CH4组成的混合气体共6.72g,其相对氢气的密度为14,将该气体与足量的氧气充分反应后的产物(水为气态)通过足量的Na202粉末,使Na202粉末增重的质量为 ( )
A.等于6.72g B.大于6.72g C. 小于6.72g D.无法计算
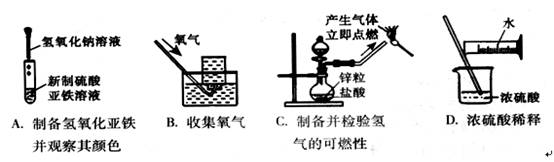
9.下列实验能达到实验目的且符合安全要求的是


8.下列反应的离子方程式书写正确的是( )
A.AgNO3溶液中加入过量氨水:Ag++NH3·H2O=AgOH↓+NH4+
B.Mg(HCO3)2溶液与过量NaOH溶液混合:Mg2++4OH-+2HCO3-=Mg(OH)2↓+2H2O+2 CO32-
C.碳酸钙溶于过量的甲酸:CaCO3+2H+=Ca2++CO2↑+H2O
D.溴化亚铁溶液中通人过量氯气:2Fe2++2Br- +2 C12=2Fe3++4Cl-+Br2
7. 下列叙述中正确的是 ( )
A.酸酐一定是酸性氧化物,非金属氧化物不一定是酸性氧化物
B.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
C.电离出的阳离子全部是H+的物质一定是酸
D.纯碱既是碱又是盐
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com