
20. (10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
(10分)工业上以黄铁矿为原料生产硫酸主要分为三个阶段进行,即煅烧、催化氧化、吸收。请回答下列各问题:
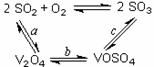
(1)催化氧化所使用的催化剂钒触媒(V2O5)能加快二氧化硫氧化速率,此过程中产生了一连串的中间体(如图)。其中过程a的化学方程式可表示为 ▲ 。
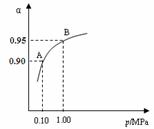 (2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
(2)一定温度时,SO2转化为SO3的平衡转化率(α)与体系总压强(p)的关系如右图所示。A与B表示不同压强下的SO2转化率,通常情况下工业生产中
采用常压的原因是 ▲ 。
(3)下列有关硫酸工业生产的说法正确的是(填字母序号) ▲ 。
A.粉碎黄铁矿使其充分燃烧
B.过量空气能提高SO2的转化率
C.吸收塔中使用稀硫酸自上而下逆向吸收SO3
D.沸腾炉排出的矿渣可供炼铁
(4)硫酸工业的尾气与氨水反应所得到的高浓度溶液中,再按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体,析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该结晶水合物的相对分子质量为134,则其化学式为 ▲ 。生产中需要向溶液中加入适量的对苯二酚等物质,其作用是 ▲ 。
19. (12分)随着石油资源的日趋紧张,天然气资源的开发利用受到越来越多的关注。以天然气为原料经由合成气(CO 、H2)制化学品是目前天然气转化利用的主导技术路线,主要工艺有以下几种:
(1)甲烷的部分氧化。CH4(g) + 1/2O2 (g) = CO (g) + 2H2(g) ,△H = -35.6 kJ/mol。该反应是 ▲ 反应(填“自发”、“非自发”或“一定条件下自发”)。有研究认为甲烷部分氧化的机理为:
①CH4(g) + 2O2 (g) = CO 2(g) + 2H2O(g) ,△H1 =-890.3 kJ/mol
②CH4(g) + CO2 (g) = 2CO (g) + 2H2(g) ,△H2 = 247.3 kJ/mol
③CH4(g) + H2O (g) = CO (g) + 3H2(g) ,△H3
 反应③的△H3= ▲ 。
反应③的△H3= ▲ 。
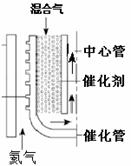
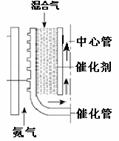
(2)甲烷水蒸汽催化重整。如图,反应时热氦气从下部流入提供能量。由甲烷和水蒸汽组成的混合气从催化管的上部流入,发生吸热反应,混合气从下端出来后再向上进入中心管,其目的是 ▲ 。根据下表数据计算甲烷
的转化率为 ▲ 。
|
气体 |
进口温度/℃ |
进口压强/MPa |
进口流量/g.s-1 |
出口流量/g.s-1 |
|
甲烷 |
464 |
4.26 |
12 |
5.4 |
(3)甲烷二氧化碳催化重整。高温下,该反应速率明显降低的原因可能是 ▲ 。
(4)甲烷的部分氧化与重整耦合。以天然气为燃料的发电尾气(主要含CO2、H2O、O2 和N2)与甲烷可直接用于制合成气,下列说法错误的是 ▲ 。(填字母序号)
A.直接利用烟气中的CO2,可以大规模地减少 CO2的排放量
B.烟气的出口温度较高,可以显著地节约能量
C.使用恰当的催化剂可以增大甲烷的转化率
D.由于反应体系中包含甲烷燃烧,可实现部分热量自供,降低成本
18. (12分)工业生产无铁硫酸铝,以硫酸浸取铝土矿得含铁(Fe2+和Fe3+)的硫酸铝溶液,加热到一定温度,搅拌,加入一定量高锰酸钾溶液和硫酸锰溶液,在溶液中生成活性二氧化锰,调节溶液的pH,反应一段时间,Fe (OH) 3和二氧化锰发生吸附共沉作用,最终得到无铁硫酸铝产品。
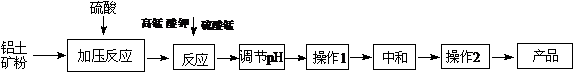
(1)KMnO4首先将Fe2+氧化为Fe3+,其本身被还原为MnO2,反应的离子方程式为 ▲ 。
(2)写出高锰酸钾溶液和硫酸锰溶液反应的化学方程式 ▲ 。实验证明,n(MnO2)/n(Fe)控制在4∶1时,除铁效果较好。若溶液中亚铁离子和铁离子浓度均为0.03 mol/L,为达到较好的除铁效果,每1 L溶液应加入高锰酸钾的物质的量为 ▲ 。
(3)调节pH的作用是 ▲ 。
(4)操作1的名称为 ▲ ,操作2的名称为 ▲ 。
(5)下列有关工艺的说法正确的是 ▲ 。(填字母序号)
A.可以向溶液中再加入铝土矿粉等调节pH
B.溶液的碱性越强,则除铁效果越好,但同时会影响硫酸铝的产率
C.活性二氧化锰生成量应适宜,不足时铁的去除率较低,过量时会增加成本
D.可以直接向溶液中加入二氧化锰粉末以除去Fe (OH) 3
17.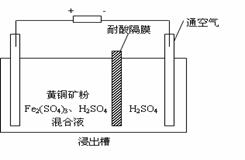 (8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
(8分)以石墨为电极,电解法处理黄铜矿(CuFeS2)精矿,可以制得硫酸铜溶液和单质硫。黄铜矿在阳极的浸出反应比较复杂,主要有:
CuFeS2 + 4H+ = Cu2+ + Fe2+ + 2H2S,
CuFeS2 + 4Fe3+ = Cu2+ + 5Fe2+ + 2S,
2Fe3+ + H2S = 2H+ + S↓ + 2Fe2+。右图为该工艺的示意图。
(1)电解过程实现了Fe3+的循环,则阳极方程式为 ▲ 。
(2)电解过程中阴极析出的金属为 ▲ ,向阴极通空气的原因是 ▲ 。
(3)与燃烧法炼铜相比,电解法的优点为 ▲ 。
16.(10分)二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂。常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定。温度过高,二氧化氯的水溶液有可能爆炸。某研究小组设计如图所示实验制备ClO2。
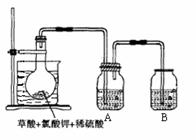 (1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热。反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为: ▲ ,氧化产物与还原产物的物质的量之比为 ▲。
(2)控制水浴温度在60-80℃之间的目的是 ▲ ,图示装置中缺少的一种必须的玻璃仪器是 ▲ 。
(3)A装置用于吸收产生的二氧化氯,其中最好盛放 ▲ 。(填序号)
①60 ℃的温水 ②冰水 ③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量用稀硝酸酸化过的氯化钡溶液,有白色沉淀生成。请写出二氧化氯溶液和硫化氢溶液反应的离子方程式 ▲ 。
15.(10分)我国化学家侯德榜改革国外的Na2CO3生产工艺,创造了侯氏制碱法,又叫联碱法,该法是将合成氨工厂生产的NH3及副产品CO2,通入到饱和食盐水中得到NaHCO3,分离出的NaHCO3加热制得Na2CO3。某研究性学习小组设计如下图所示的模拟装置,该装置可实现部分原料的循环使用。
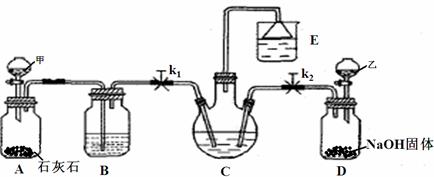 (1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(1)分液漏斗甲中为盐酸,装置B中试剂为 ▲ ,分液漏斗乙中是易挥发的某试剂,该试剂为 ▲ 。
(2)实验操作过程中,应先打开 ▲ (填“k1”或“k2”),当观察到 ▲ 现象时,再打开另一个弹簧夹。
(3)装置E中试剂为饱和NaCl溶液,该装置能体现绿色化学思想的两个作用是 ▲ 、 ▲ 。
(4)老师认为在C、D之间还应增加一个装置,该装置作用为 ▲ 。
14. 将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.8mol,这些气体恰好能被500 mL 2 mol/L NaOH溶液完全吸收,生成的盐溶液中NaNO3的物质的量为(已知:2NO2+2NaOH=NaNO2+NaNO3+H2O ,NO+NO2+2NaOH
=2NaNO2+H2O。)
A.0.2 mol B. 0.4 mol C.0.6 mol D. 0.8 mol
非 选 择 题(共72分)
13. 下列溶液中微粒的物质的量浓度关系正确的是
A.NaHCO3溶液中:
B.pH=3的CH3COOH与pH=11的NaOH溶液等体积混合后的溶液中:c(H+)>c(OH-)
C.0.1 mol/L的NH4Cl溶液中: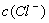 >
>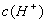 >
>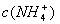 >
>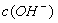
D.物质的量浓度相等的CH3COOH 和CH3COONa溶液等体积混合后的溶液中:
2c(Na+)=c(CH3COOH)+c(CH3COO-)
12. 科学家P.Tatapudi等人首先使用在空气中电解水(酸性条件下)的方法,阳极制得臭氧,阴极制得过氧化氢。电解总方程式为:3H2O+3O2 3H2O2+O3,下列说法正确的是
3H2O2+O3,下列说法正确的是
A.阴极反应:3O2+6H2O+6e-=3H2O2+6OH-
B.阳极反应:3H2O-6e-= O3+6H+
C.每生成标准状况下22.4 L O3转移电子数为3 moL
D.电解一段时间后,溶液pH不变
11. 下列离子方程式与所述事实相符且正确的是
A.0.5 mol/L NaHSO4与0.5 mol/L Ba(OH)2混合至溶液呈中性:
Ba2++OH-+SO42-+H+=BaSO4↓+H2O
B.向2 mol/L Fe(NO3)2(aq)中滴加少量氢碘酸:3Fe2++NO3-+4H+=3Fe3++NO↑+2H2O
C.向20 mL 0.5 mol/L FeBr2(aq)中通入224 mL Cl2(标准状况):
2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl-
D.向30 mL 0.5 mol/L NaOH(aq)中通入224 mL CO2(标准状况):
3OH-+2CO2=CO32-+HCO3-+H2O
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com