
17.(10分)某硝酸厂附近的空气主要污染物为氮的氧化物。为了保护环境和综合利用,可采用氨-碱两级吸收法。此法兼有碱吸收和氨吸收两法的优点,其吸收工艺流程如下:
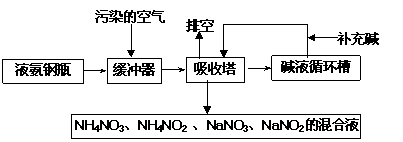
(1)排空物质的主要成分为____________________________。
(2)进入吸收塔以前加一个缓冲器的目的是________________________________。
(3)从吸收塔排出的混合液用途之一为________________ 。
空气的主要污染物为硫的氧化物和氮的氧化物。研究人员设计了同时净化废气中二氧化硫和氮的氧化物的方法,将其转化为硫酸和硝酸,工艺流程如下:
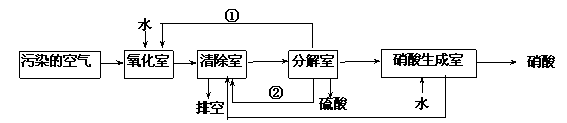
各室中发生的反应如下:
a.氧化室:NO2(g) + SO2(g) + H2O (l)=H2SO4 (l)+ NO(g)△H=a kJ·mol-1
b.清除室:NO (g)+ NO2 (g)= N2O3(g) △H= b kJ·mol-1
N2O3 (g)+ 2H2SO4(l) = 2NOHSO4 (s)+ H2O(l) △H=c kJ·mol-1
c.分解室:4NOHSO4 (s)+ O2 (g)+ 2H2O (l)= 4H2SO4 (l)+ 4NO2(g) △H= dkJ·mol-1
回答下列问题:
(4)①和②分别为(写化学式)______________、_____________。
(5)写出SO2、 O2 和 H2O反应生成H2SO4的热化学方程式:
____________________________________________________________。
16.(10分)利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤。已知: §SO2(g) +1/2O2(g) SO3
SO3 (g) △H=-98 kJ·mol-1。
(g) △H=-98 kJ·mol-1。
(1)某温度下该反应的平衡常数K=10/3,若在此温度下,向100 L的恒容密闭容器中,充入3.0 mol SO2(g)、16.0 mol O2(g)和3.0 mol SO3(g),则反应开始时v(正) v(逆)(填“<”、“>”或“=”)。
 (2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为
。
(2)一定温度下,向一带活塞的体积为2 L的密闭容器中充入2.0 mol SO2和1.0 mol O2,达到平衡后体积变为1.6 L,则SO2的平衡转化率为
。
(3)在(2)中的反应达到平衡后,改变下列条件,能使SO2(g)平衡浓度比原来减小的是 (填字母)。
A.保持温度和容器体积不变,充入1.0 mol O2
B.保持温度和容器内压强不变,充入1.0 mol SO3
C.降低温度
D.移动活塞压缩气体
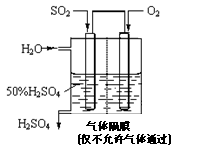
(4)若以右图所示装置,用电化学原理生产硫酸,写
出通入O2电极的电极反应式为 。
(5)为稳定持续生产,硫酸溶液的浓度应维持不变,
则通入SO2和水的质量比为____________。
15.(10分)重晶石矿石主要含有BaSO4,还含有少量的SiO2、Al2O3、Fe2O3、MnO2、
FeS2、Na2O、K2O等杂质。以下是某工业制备硫酸钡以及分离某些金属的流程图。
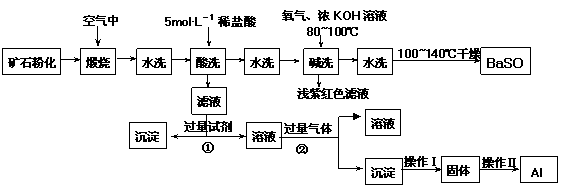
(1)煅烧过程中产生的污染性气体主要是 。
(2)确定第一次水洗液中有K+存在的实验现象是 。
(3)写出碱洗时的氧化还原反应方程式 。
(4)①反应生成沉淀的化学式 ,②反应的离子方程式为 。
(5)操作Ⅰ为 ,操作Ⅱ为 。
14.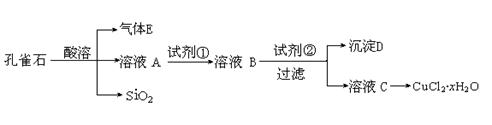 (8分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作反应的催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
(8分)氯化铜晶体(CuCl2·xH2O)是重要的化工原料,可用作反应的催化剂、消毒剂等。用孔雀石[主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物]制备氯化铜晶体,方案如下:
已知:Ⅰ.Cu(OH)2、CuO开始分解的温度分别为80℃和900℃。
Ⅱ.有关金属离子从开始沉淀到沉淀完全时溶液的pH:
|
|
开始沉淀的pH |
沉淀完全的pH |
|
Fe3 |
2.7 |
3.7 |
|
Cu2+ |
5.2 |
6.4 |
|
Fe2+ |
7.6 |
9.6 |
(1)若溶液A含有的金属离子有Cu2+、Fe2+、Fe3+,则试剂①最好为 (填字母)。
a.(NH4) 2S b.H2O2 c.NaClO d.Cl2
(2)加试剂②的目的是 ,由溶液C获得CuCl2·xH2O,需要经过加热浓缩、 、过滤等操作。
(3)为了测定制得的氯化铜晶体(CuCl2·xH2O)中x值,有如下两种实验方案:
方案一:称取a g晶体灼烧至质量不再减轻为止,冷却、称量所得无水CuCl2的
质量为b g。
方案二:称取a g晶体、加入足量氢氧化钠溶液,过滤、洗涤、加热沉淀(控制温度约为120℃)至质量不再减轻为止,称量所得固体的质量为b g。
则上述两种实验方案中,不合理的是 ,原因是 。
依据合理方案计算得x = (用含a、b的代数式表示)。
13.(6分)工业纯碱中常常含有NaCl、Na2SO4等杂质。为测定某工业纯碱的纯度,设计了如下图实验装置。
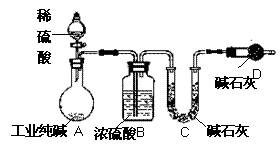 依据实验设计,请回答:
依据实验设计,请回答:
(1)装置中盛装稀硫酸的仪器名称是 ;
装置D的作用是 。
(2)为达到实验目的,一次实验中至少应
进行称量操作的次数为 。
(3)若不考虑操作、药品及其用量等方面
的影响,该实验测得结果会 (填“偏高”、“偏低”、“无影响”);
原因是 (你若认为无影响,该空不用回答)。
12、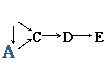 A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如右图所示的转化,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是
A、B、C、D、E都是中学化学中常见物质,它们均含有同一种短周期元素,在一定条件下可发生如右图所示的转化,其中A是单质,B常温下是气态氢化物,C、D是氧化物,E是D和水反应的产物。下列判断中不合理的是
A.A不可能是金属 B.由C生成D肯定发生了电子转移
C.A生成C肯定属于离子反应 D.B和E可能会发生反应生成一种盐
非 选 择 题
11、下图中,图1为甲烷和O2构成的燃料电池,图2为电解MgCl2溶液装置。用该装置进行实验,反应开
始后,观察到x电极附近出现白色沉淀。下列说法正确的是
A.A处通入的气体为CH4,B处通入的气体为O2
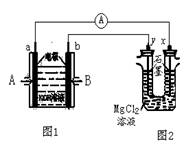 B.电池内部K+向b极移动,老虎OH-向a极移动
B.电池内部K+向b极移动,老虎OH-向a极移动
C.图1装置中发生的总反应为:
CH4+2O2===CO2+3H2O
D.图1、图2中电解质溶液的pH均增大
10.下列溶液中微粒的物质的量浓度关系正确的是
A.0.1 mol·L-1的NH4Cl溶液与0.05 mol·L-1的NaOH溶液等体积混合后的溶液:
c(Cl-) > c(Na+) > c(NH4+) > c(OH-) > c(H+)
B.等物质的量的NaClO、NaHCO3混合溶液中:
c(HClO) + c(ClO-) = c(HCO3-) + c(H2CO3) + c(CO32-)
C.pH=2的HA溶液与pH=12的MOH溶液等体积混合:
c(M+) = c(A-)>c(OH-) = c(H+)
D.某二元弱酸的酸式盐NaHA溶液:c(OH-) + c(H2A) = c(H+) + 2c(A2-)
9.下列反应的离子方程式中正确的是
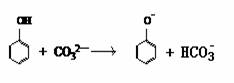 A.硫酸亚铁溶液在空气中氧化:Fe2++3O2+6H2O=4Fe(OH)3↓
A.硫酸亚铁溶液在空气中氧化:Fe2++3O2+6H2O=4Fe(OH)3↓
B.向苯酚溶液中滴入少量Na2CO3溶液:
C.向Na2SO3、NaI的混合溶液中滴加少量氯水:2I -+Cl2==2Cl-+I2
D.1mol·L-1的NaAlO2溶液和2.5 mol·L-1的HCl溶液等体积混合:
2AlO2-+5H+ =Al(OH)3↓+Al3++H2O
8. 科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种。下列关于A的说法正确的是
科学家研制出多种新型杀虫剂代替DDT,化合物A是其中的一种。下列关于A的说法正确的是
A.A的分子式为C15H22O3
B.与FeCl3溶液发生反应后溶液显紫色
C.分子中有3个手性碳原子
|
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com