
12. 已知25℃,AgI饱和溶液中,C(Ag+)=1.22
已知25℃,AgI饱和溶液中,C(Ag+)=1.22 10-8mol/L
10-8mol/L ,AgCl饱和溶液中,C(Ag+)=1.25
,AgCl饱和溶液中,C(Ag+)=1.25 10-5mol/L,若在5ml含有KCl和
10-5mol/L,若在5ml含有KCl和 各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
各为0.01mol/L的溶液中加入8mL0.01mol/L的AgNO3溶液,这时溶液中所含溶质的离子浓度大小关系正确的是
A.C(K+)<C(NO3-)<C(Ag+)<(Cl-)<C(I-) B.C(NO3-)>C(K+)> C(Ag+)>C (Cl-)>C(I-)
C.C(K+)<C(NO3-)<C(Cl-)<C(Ag+)<C(I-) D.C(K+)>C(NO3-)>C(Cl-)>C(Ag+)>C(I-)
11.已知X、Y、Z为三种主族元素,分别形成Xn+、Ym+、Zn-三种简单离子,已知n>m ,下列说法中正确的是
A.三种离子中,Ym+离子的半径最小 B.Z的最高价氧化物的水化物的分子式为HnZO4
C.X、Y、Z在同一周期时,原子半径X﹤Y﹤Z
D.三种元素相应的最高价氧化物的水化物之间可能会两两发生反应
10.分别取PH=3的两种一元酸HA和HB溶液10mL,加入等量(过量)的镁粉,充分反应后收集到H2的体积在相同状况下分别为V1和V2。下列说法中正确的是
A、若它们都是弱酸,则V1和V2在标准状况下一定相等。
B、若V1大于V2,则相同条件下,NaA溶液的碱性弱于NaB溶液的碱性
C、将HA和HB溶液稀释相同的倍数,若PH(HA)>PH(HB),则酸性:HA>HB
D、反应开始时HA和HB溶液的物质的量浓度不相等,二者生成H2的速率不同
9.下列装置或操作能达到实验目的的是
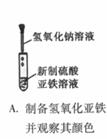
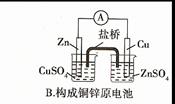
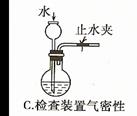
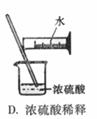
8.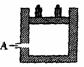 如右图所示为一恒压容器。在恒定温度下,将1mol N2和3 mol H2混合后由A口快速充入容器,封闭A,反应
如右图所示为一恒压容器。在恒定温度下,将1mol N2和3 mol H2混合后由A口快速充入容器,封闭A,反应

 在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4时刻。在0-t4时间内混合气体中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是
在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,封闭A,t3时刻重新达平衡至t4时刻。在0-t4时间内混合气体中NH3的体积分数(纵坐标)随时间(横坐标)变化的曲线正确的是
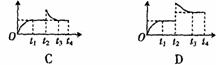
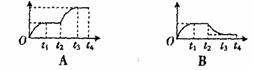
7.2006年1月,我国研制出能在超低温状态下工作的镍氢电池。氢镍电池是近年开发出
的可充电电池,它可以取代会产生镉污染的镉镍电池。氢镍电池的总反应式是: H2+2NiO(OH) 放电充电2Ni (OH)2 , 根据此反应判断,下列叙述中正确的是
A.电池放电时 ,电池负极周围溶液的pH不断增大
B.电池充电时,阳极电极反应式:NiO(OH)+e- + H2O = Ni (OH)2 + OH-
C.电池充电时, 镍元素被氧化 D.电池放电时,H2是正极
6.有一混合溶液,只含有Fe2+、Cl-、Br-、I-(忽略水的电离),其中Cl-、Br-、I-的个数比为2∶3∶4。向该溶液中通入氯气,使溶液中Cl-和Br-的个数比为3∶1,则溶液中消耗Fe2+的物质 的量与通入氯气的物
的量与通入氯气的物 质的量之比为(已知还原性:I->Fe2+>Br->Cl-)
质的量之比为(已知还原性:I->Fe2+>Br->Cl-)
A.6∶7 B.7∶4 C.7∶5 D.7∶6
5.下列各组离子一定能大量共存的是
A .在碳酸氢钠溶液中:Na+、K+、AlO2-、CO32-
.在碳酸氢钠溶液中:Na+、K+、AlO2-、CO32-
B、在水电离出的c(H+)=1.0×10-13mol/L的溶液中:NH4+、Na+、S2-、AlO2-、
C.在含大量Fe3+的溶液中:NH4+、Na+、Cl-、SO42-
D.使pH试纸变红的溶液:Na+、Mg2+、NO3-、I-
4.在一密闭容器中有甲醛、氧气、氢气共16.5g,用电火花引燃,使其完全燃烧,再将燃
烧后的气体用Na2O2充分吸收,Na2O2增重8.5g,则原混合气体中O2的物质的量是
A.0.25 mol B.0.50mol C.0.27 mol D.0.52 mol
3. 短周期元素X、Y的原子序数相差2,下列叙述正确的是
A.X与Y不可能位于同一周期
B.X与Y不可能形成原子个数比为1:1型离子化合物
C.X离子与Y离子电子层结构可以相同,也可以不同
D.X与Y形成的共价化合物中,各原子最外层一定满足8电子的稳定结构
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com