
2.《剑桥中国史》中写道:“在唐代,科举考试不过产生一批官僚精英分子而已。其数量可能略多于全部官僚集团的10%。总之,其中大部分人出身于名门望族,都来自书香门第。在唐朝灭亡以前,这种情况没有改变。”材料反映了
A.九品中正制依然存在 B.科举制度在唐代没有执行
C.唐代官员都是科举出身 D.科举考试有利于人才选拔
1.儒家经典《大学》把君子人格的修养和完成制定为“修身、齐家、治国、平天下”的程序下,从个人到“家”、到“天下”的一种层次扩展的关系。实质上体现了
A.王位继承制 B.宗法制 C.分封制 D.专制主义中央集权制
24.(10分) 近来,《饮用天然矿泉水》新标准引起热议,其中备受争议的溴酸盐是一种致癌物,新标准中溴酸盐限值为0.01mg/L 。已知在酸性条件下有以下反应:
①2BrO3−+I2=2IO3−+Br2 ; ②2IO3−+10Br−+12H+=I2+5Br2+6H2O
请回答下列问题:
(1)有同学根据反应①得出氧化性:I2>Br2的结论,你认为是否正确?(若认为正确则填“正确”,若认为不正确则填“不正确”并说明理由) 。
(2)现向含6 mol KI的硫酸溶液中逐滴加入KBrO3溶液,整个过程中含碘物质的物质的量与所加入KBrO3的物质的量有如图所示关系:
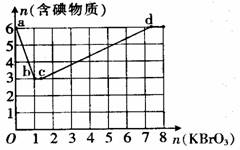 ① a→b阶段的反应中氧化剂与还原剂的物质的量之比为
。b点时,KI全部参与反应,则b点对应的含碘物质的化学式为
。
① a→b阶段的反应中氧化剂与还原剂的物质的量之比为
。b点时,KI全部参与反应,则b点对应的含碘物质的化学式为
。
② b→c阶段的反应中,只有一种元素的价态发生了变化,此阶段反应的离子方程式为 。
③ n (KBrO3)=4 mol时,对应含碘物质的化学式为 。
④ 含a mol KI的硫酸溶液所能消耗KBrO3物质的量的最大值为 mol。

|

|
 版权所有:()
版权所有:()
版权所有:()
版权所有:()
辽宁省锦州市2010届高三上学期期末考试
23.(14分)超音速飞机在平流层飞行时,尾气中的NO会破坏臭氧层。科学家正在研究利用催化技术将尾气中的NO和CO转变成CO2和N2,其化学反应方程式为:
2NO+2CO 2CO2+N2 △H<0 。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(生成物起始浓度均为0)如表:
2CO2+N2 △H<0 。为了测定在某种催化剂作用下的反应速率,在某温度下用气体传感器测得不同时间的NO和CO浓度(生成物起始浓度均为0)如表:
|
时间(s) |
0 |
1 |
2 |
3 |
4 |
5 |
|
c(NO)(mol/L) |
1.00×10-3 |
4.50×10-4 |
2.50×10-4 |
1.50×10-4 |
1.00×10-4 |
1.00×10-4 |
|
c(CO)(mol/L) |
3.60×10-3 |
3.05×10-3 |
2.85×10-3 |
2.75×10-3 |
2.70×10-3 |
2.70×10-3 |
请回答下列问题(均不考虑温度变化对催化剂催化效率的影响):
(1)前2s内的平均反应速率υ(N2)= 。
(2)在该温度下,反应的平衡常数K= 。
(3)研究表明:在使用等质量催化剂时,增大催化剂比表面积可提高化学反应速率。为了分别验证温度、催化剂比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。
|
实验 编号 |
T(℃) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比表面积(m2/g) |
|
Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
|
Ⅱ |
|
|
|
124 |
|
Ⅲ |
350 |
|
|
124 |
①请在上表空格中填入剩余的实验条件数据。
②请在给出的坐标图中,画出上表中的三个实验条件下混合气体中NO浓度随时间变化的趋势曲线图,并标明各条曲线的实验编号。

22.(12分) 已知A和B两支试管的溶液中共含有K+、Ag+、Mg2+、Cl−、OH−、NO3− 六种离子,向试管A的溶液中滴入酚酞试液呈粉红色。请回答下列问题:
(1)试管A的溶液中所含上述离子共有 种。
(2)若向某试管中滴入稀盐酸产生沉淀,则该试管为 (填“A”或“B”)。
(3)若向试管B的溶液中加入合适的药品,过滤后可以得到相应的金属和仅含一种溶质的溶液,则加入的药品是 (填化学式)。
(4)若将试管A和试管B中的溶液按一定体积比混合过滤后,蒸干滤液可得到一种纯净物,则混合过程中发生反应的离子方程式为 、 。
(5)若试管A和试管B中共有四种物质按等物质的量溶解于试管中,再将A和B中的溶液混合过滤,所得滤液中各种离子的物质的量之比为 。
(6)若向由试管A的溶液中阳离子组成的碳酸氢盐溶液中,滴入少量Ba(OH)2溶液,则发生反应的离子方程式为 。
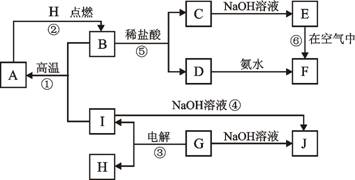
21.(12分)A-I分别表示中学化学中常见的一种物质,它们之间相互关系如下图所示(部分反应物、生成物没有列出),且已知G为主族元素的固态氧化物,A、B、C、D、E、F六种物质中均含同一种元素。
请填写下列空白:
(1)A、B、C、D、E、F六种物质中所含同一种元素的名称为 ;
(2)若C→D为化合反应,则此时的化学方程式 ;
(3)写出反应④的离子方程式 ;
(4)写出反应③的电极方程式:阳极 ; 阴极 。
(5)从能量变化的角度看,①②③反应中属于△H>0的反应是_______。(填序号)
20.半导体工业用石英砂做原料,通过三个重要反应生产单质硅:
①SiO2(s)+2C(s) = Si(s)+2CO(g) △H = +682.44 kJ/mol
(石英砂) (粗硅)
②Si(s)+2Cl2(g) = SiCl4(g) △H = -657.01kJ/mol
(粗硅)
③SiCl4(g)+2Mg(s) = 2MgCl2(s)+Si(s) △H = -625.63 kJ/mol
(纯硅)
生产1.00kg纯硅的总反应热为
A.+2.43×104kJ B.-2.35×104kJ C.-2.23×104kJ D.-2.14×104kJ
第Ⅱ卷 (非选择题,共48分)
19.一定温度下,可逆反应:A(s) + 2B(g) 2C(g) + D(g) DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
2C(g) + D(g) DH<0。现将1 mol A和2 mol B加入甲容器中,将4 mol C和2 mol D加入乙容器中,此时控制活塞P,使乙的容积为甲的2倍,t1时两容器内均达到平衡状态(如图1所示,隔板K不能移动)。下列说法正确的是
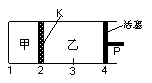

图1
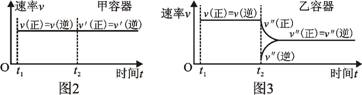
A.保持温度和活塞位置不变,在甲中再加入1 mol A和2 mol B,达到新的平衡后,甲中C的浓度是乙中C的浓度的2倍
B.保持活塞位置不变,升高温度,达到新的平衡后,甲、乙中B的体积分数均减小
C.保持温度不变,移动活塞P,使乙的容积和甲相等,达到新的平衡后,乙中C的体积分数是甲中C的体积分数的2倍
D.保持温度和乙中的压强不变,t2时分别向甲、乙中加入等质量的氦气后,甲、乙中反应速率变化情况分别如图2和图3所示(t1前的反应速率变化已省略)
18.a、b、c、d、e分别为MgCl2、KHSO4、KOH、NaHCO3、AlCl3五种溶液中的一种,其中a能与其余四种溶液反应,且a、d反应时无明显现象;b与d反应只产生气泡;e只能与a反应。下列推理不正确的是
A.a一定为KOH溶液 B.b一定为KHSO4溶液
C.c一定为AlCl3溶液 D.e一定为MgCl2溶液
17. 右图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学反应方程式为:
右图所示装置Ⅰ是一种可充电电池,装置Ⅱ为电解池。离子交换膜只允许Na+通过,充放电的化学反应方程式为:
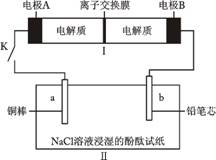 2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关
2Na2S2+NaBr3 Na2S4+3NaBr。闭合开关
K时,b极附近先变红色。下列说法正确的是
A.负极反应为4Na 4e−=4Na+
4e−=4Na+
B.当有0.01 mol Na+通过离子交换膜时,b电极
上析出标准状况下的气体112 mL
C.闭合K后,b电极附近的pH变小
D.闭合K后,a电极上有气体产生
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com