
4.设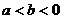 ,则下列不等式中不成立的是 ( )
,则下列不等式中不成立的是 ( )
A.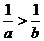 B.
B.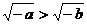 C.
C.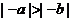 D.
D.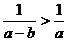
3.函数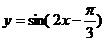 的一条对称轴方程是 ( )
的一条对称轴方程是 ( )
A.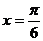 B.
B.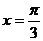 C.
C.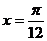 D.
D.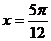
2.抛物线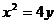 的焦点坐标为 ( )
的焦点坐标为 ( )
A.(1,0) B.(0,1) C.(0,2) D.(2,0)
1.设集合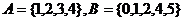 ,全集
,全集 = ( )
= ( )
A.{0,3,5} B.{1,2,4}
C.{0,3,4,5} D.{0,1,2,3,4,5}
28.(8分)将3.2 g Cu溶于a mol/L过量的硝酸30 mL中,假设硝酸的还原产物只有NO和NO2,反应结束后,将所得溶液加水稀释至1000 Ml,测得c(NO3-)为0.2 mol/L。求:
(1)稀释后溶液中H+的物质的量浓度为 。
(2)生成的气体中NO2的物质的量为 ,NO的物质的量为 。(用含a的关系式表示)。
(3)用NaOH溶液吸收氮的氧化物是防止NOx污染的一种方法。原理为:
 2NO2+2NaOH=NaNO3+NaNO2+H2O
2NO2+2NaOH=NaNO3+NaNO2+H2O
NO2+NO+2NaOH=2NaNO2+H2O
若题中所述生成的混合气体能被NaOH溶液完全吸收,则a的取值范围为
。
27.(12分)
某化学兴趣小组采用下列方法测定Na2SO3样品中Na2SO4的质量分数。
[方法一]加热转化法
称取a g样品,置于硬质玻璃管中,通入足量的氧气加热到质量不再改变。
若冷却后称得固体质量为b g,则样品中Na2SO4质量分数为
[方法二]测SO2质量法
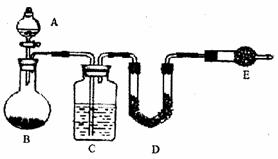
采用如图所示装置,通过实验测定生成SO2的质量。
(1)C中所装药品为 ;D中所装药品为 。
(2)E装置的作用为 。
[方法三]测沉淀质量法
第一步:称取e g样品,置于小烧杯中;
第二步:向小烧杯中加入足量稀盐酸,充分反应后加热;
第三步:向小烧杯中加入足量BaCl2溶液,然后过滤、洗涤:
第四步:干燥沉淀,称重为f g。
(1)第二步中加热的目的是 。
(2)简述洗涤沉淀的方法: 。
26.(12分)
某兴趣小组探究SO2气体的性质,他们使用的药品和装置如下图所示:
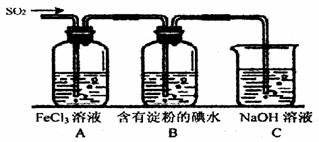
(1)SO2气体与Fe3+反应的还原产物是 (填离子符号),参加反应的SO2和Fe3+的物质的量之比是 。
(2)下列实验方案适用于在实验室制取所需SO2的是 (填序号)。
A.Na2SO3溶液与HNO3
B.Na2SO3浓溶液与浓硫酸
C.固体硫在纯氧中燃烧
(3)装置C的作用是 。
(4)若要从A中所得溶液提取晶体,必须进行的实验操作步骤:蒸发、冷却结晶、 、自然干燥,在这一系列操作中没有用到的仪器有 (填序号)。
A.蒸发皿 B.石棉网 C.漏斗 D.玻璃棒
(5)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中的溶液,分成三份,并设计了如下实验:
方案①:往第一份试液中加入酸性KMnO4溶液,紫色褪去
方案②:往第二份试液中加入KSCN溶液不变红,再加入新制的氯水,溶液变红,
方案③:往第三份试液中加入用盐酸酸化的BaCl2溶液,产生白色沉淀
上述方案不合理的是 ,原因是 。
(6)能表明I一的还原性弱于SO2的现象是 。
25.(13分)
下图为各单质与化合物之间的转化关系,单质及化合物的组成元素均为常见的短周期元素。请回答:
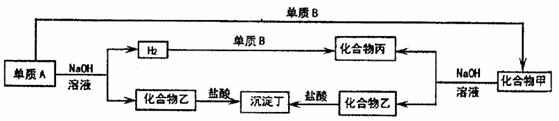
(1)若沉淀丁不溶于过量的盐酸,甲为 ,乙为 。
若沉淀丁能溶于过量的盐酸,丁为 。
(2)单质B的化学式为 ,丙的电子式为 。
(3)若沉淀丁不溶于过量的盐酸,写出A和NaOH溶液反应的化学方程式:
。
24.(12分)
短周期元素Q、R、T、W在元素周期表中的位置如图所示,其中T所处的周期序数与主族序数相等,请回答下列问题:
|
|
Q |
R |
|
|
T |
|
|
W |
(1)T的原子结构示意图为 。
(2)W的单质与其最高价氧化物的水化物浓溶液共热能发生反应,生成两种物质。其中一种是气体,反应的化学方程式为 。
(3)Q、R元素可以形成一种新型的耐高温陶瓷材料,其化学式为 ,属于 晶体。
(4)Q、W元素组成的液态化合物,其结构式为 。1 mol该化合物在空气中燃烧,消耗3 mol O2,生成两种气体化合物,放出热量a kJ。写出该反应的热化学方程式: 。
23.(12分)
A、B、C、D是按原子序数由小到大排列的第二、三周期元素的单质。 B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
B、E均为组成空气的成分。F的焰色反应呈黄色。在G中,非金属元素与金属元素的原子个数比为1:2。在一定条件下,各物质之间的相互转化关系如图(图中部分产物未列出):
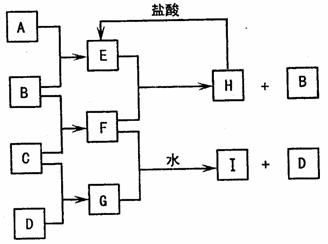
请填写下列空白:
(1)A是 ,C是 ,F的电子式为 。
(2)H与盐酸反应生成E的化学方程式是 。
(3)E与F反应的化学方程式是 。
(4)F与G的水溶液反应生成I和D的离子方程式是 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com