
8.下列说法正确的是
( )
A.将25℃纯水加热至95℃时,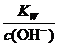 增大
增大
B.pH=12的:Na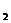 CO
CO 溶液加水稀释,溶液中所有的离子浓度均降低
溶液加水稀释,溶液中所有的离子浓度均降低
C.室温下,pH=a盐酸与pH=b的氨水等体积混合后pH=7,则a+b=14
D.0.1 mol·L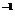 酸HA与0.1 mol·L
酸HA与0.1 mol·L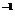 NaOH溶液等体积混合后pH>7,则
NaOH溶液等体积混合后pH>7,则
c(Na+)= c (A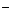 )+ c (HA)=O.1 mol·L
)+ c (HA)=O.1 mol·L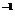
7.有关下列有机物结构描述正确的是
( )
A.乙烯基乙炔 (CH2=CH-C≡CH )分子中不可能所有原子共面
B.(CH3)2
C =C(CH3)2分子中六个碳原子能够处在同一平面上
C.2-丁炔分子中四个碳原子不可能处在同一条直线上
D.没有支链的烷烃,其碳链都呈直线状 学
学
6.常温下,在pH=11的某溶液中,由水电离出的c (OH-)可能为
( )
①1.0×10-3 mol/L ②1.0×10-6 mol/L ③1.0×10-7 mol/L ④1.0×10-11 mol/L

A.①③ B.③
C.④ D.①④
5.对于锌、铜和稀硫酸组成的原电池(如右图),下列有关说法不正确的是 ( )
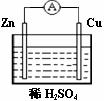 A.Zn是负极
A.Zn是负极
B.正极上发生氧化反应
 C.负极发生的反应是 Zn - 2e-
C.负极发生的反应是 Zn - 2e-
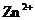
 D.正极发生的反应是 2H+
+ 2e-
H2↑
D.正极发生的反应是 2H+
+ 2e-
H2↑
4.下列有关中和滴定的叙述中正确的是
( )
A.中和滴定操作中所需标准溶液越浓越好,指示剂一般加入2-3mL
B.滴定管、锥形瓶均先水洗后润洗
C.滴定时眼睛应注视锥形瓶内溶液的颜色变化而不应注视滴定管内液面变化 网
网
D.若用标准盐酸滴定待测NaOH溶液,滴定前仰视,滴定后俯视则测定值偏大
3.高中阶段我们相继学习了同位素、同素异形体、同分异构体、同系物的概念,下列有关这四个概念说法错误的是
( )
A.因为C2H6与C3H8互称同系物,所以C2H4与C3H6一定互称同系物
B.氕、氘、氚互称同位素
C.O2与O3、红磷与白磷、金刚石与石墨互称同素异形体
D.异戊烷和2,2-二甲基丙烷互称同分异构体
2.在恒温恒容条件下,对于可逆反应2HBr(g)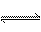 H2(g)+Br2(g),下列叙述能够说明反应达到平衡状态的是
( )
H2(g)+Br2(g),下列叙述能够说明反应达到平衡状态的是
( )
A.压强保持不变
B.断裂2mol H-Br键的同时生成1mol H-H键
C.混合气体的平均式量不变 D.混合气体颜色不再发生变化
1.常温下,下列物质溶于水,水的电离被促进,且溶液的pH小于7的是 ( )
A.NaHSO4 B.KHCO3 C.AlCl3 D.HCl
21.(9分)已知草酸晶体(H2C2O4·2H2O)受热分解的化学方程式是:
H2C2O4·2H2O CO2↑+CO↑+3H2O
CO2↑+CO↑+3H2O
(1)现提供草酸晶体、澄清石灰水、6 mol/LNaOH溶液、CuO粉末四种药品,请从下图中选用所需的仪器(可重复使用)组成一套进行该反应并检验出该反应的两种气态产物的装置(连接和固定仪器用的玻璃管、胶管、铁夹、铁架台及加热装置等均略去)。
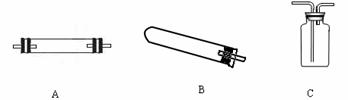
所需仪器的连接顺序是(填字母): 。
某同学认为实验会产生污染空气的尾气,必需加以处理。请你帮他想一种处理措施
。
(2)该实验中有一步用到了CuO, 实验结束后发现黑色氧化铜变为红色固体。某同学查阅资料得知Cu2O也是红色固体,且高温下比较稳定,他认为该红色固体中可能含有Cu2O,又知Cu2O+2H+=Cu2++ Cu+H2O,请你帮助他设计一个检验该红色固体中是否含有Cu2O的实验(写出操作步骤、可能出现的现象和结论)
。
(3)已知草酸和草酸钠(Na2C2O4)在酸性条件下可以被KMnO4氧化生成CO2,同时KMnO4被还原为无色溶液,某同学拟用0.01 mol/L的KMnO4溶液来测定草酸晶体的纯度(假设草酸晶体中不含有其它还原性杂质)。
其操作过程如下:
准确称取w g草酸晶体加水溶解,再加入稀硫酸酸化;将溶液全部转移入100 mL容量瓶定容;混合均匀后取出25 mL放入锥形瓶中,用0.01 mol/L KMnO4溶液滴定,平行滴定三次。终点时用去KMnO4溶液的平均体积为V mL,
①你认为上述滴定过程中是否需要另加指示剂 。
②请列式并计算该草酸晶体的纯度
。
20.(10分)合成氨反应的热化学方程式为N2(g)+3H2(g) ==2NH3(g);△H= -92 kJ/mol,在一容积为2 L的密闭容器中加入一定量的N2和 H2,在一定条件下发生合成氨反应,反应中NH3的物质的量浓度的变化情况如下图:
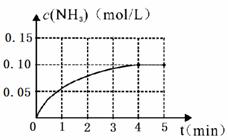
(1)根据上图,计算从反应开始到平衡时,平均反应速率v(N2)=____________;
(2)反应达到平衡时,测得NH3占平衡混合气体积的1/3,则平衡混合气体折合成标准状况下的体积是 L,反应过程中放出的热量是 kJ。
(3)平衡时测得N2的物质的量为0.1 mol,则N2转化率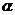 (N2)=
;
(N2)=
;
(4)实验测得一定条件下合成氨反应的速率与体系内各物质的浓度有以下关系:v=kc(N2)·c1.5(H2)·c-1(NH3) (k为一常数),请根据此速率方程,结合自己的已有知识对如何提高合成氨反应的速率提出三点建议
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com