
20.(8分)
间接碘量法测定胆矾中铜含量的原理和方法如下:
已知:在弱酸性条件下,胆矾中Cu2+ 与 I―作用定量析出 I2;I2 溶于过量的KI溶液中:I2 + I- ==I3-;且在溶液中:Fe3+ +6F- = [FeF6]3- ( 六氟合铁(III)络离子 )
又知:微粒的氧化性强弱顺序为:Fe3+>Cu2+>I2>FeF63-
析出I2可用cmol/LNa2S2O3标准溶液滴定:2S2O32- + I3- == S4O62- + 3I-。
 【设计除杂过程】
【设计除杂过程】
(1)操作①中需要使用的玻璃仪器有 、 。操作②的名称为 ,若在操作②结束后发现溶液B略有浑浊,应采取的措施是_______ ________________
________________________________________________________________________。
(2)混合液A的主要成分是____________________。(填化学式)
【检验除杂效果】
(3)为检验溶液B中Mg2+、Ca2+是否除尽,通常分别取少量溶液B于两支试管中,进行如下实验:
步骤一:检验Mg2+是否除尽。向其中一支试管中加入 溶液(填化学式),看是否有沉淀生成。
步骤二:检验Ca2+是否除尽。向另一支试管中加入某溶液,看是否有沉淀生成。效果最好的是 (填字母)。
A、Na2CO3 B、Na2SO
【获取纯净食盐】
(4)对溶液B加热并不断滴加6 mol?L―1的盐酸溶液,同时用pH试纸检测溶液,直至pH=5时停止加盐酸,得到溶液C。该操作的目的是 。
(5)将溶液C倒入 (填仪器名称)中,加热蒸发并用玻璃棒不断搅拌,直到
___________ _____________时(填现象),停止加热。
【问题讨论】
(6)在除杂过程中,向粗盐悬浊液中加混合液A时需要加热,目的是 ,该操作中控制溶液pH=12可确保Mg2+除尽,根据提供的数据计算,溶液B中Mg2+物质的量浓度将被控制在______________以下。
5.61×10―12
某研究性学习小组对粗盐的提纯和检验进行研究,并提出一些新的方案。已知该粗盐样品中主要含有不溶性杂质、Mg2+、Ca2+等(忽略SO42―的存在),该小组设计流程如下:
2.34×10―9
4.96×10―9
4.96×10―9
19.(14分)
粗盐提纯的研究。
【有关资料】
化学式
CaCO3
CaSO3
CaC2O4
Mg(OH)2
Ksp
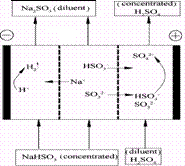 A.阳极区酸性增强
A.阳极区酸性增强
B.阴极区电极反应式为:2H++2e―=H2↑
C.diluent和concentrated的中文含义为浓缩的、稀释的
D.该过程中的副产品主要为H2SO4
18.某研究小组用NaOH溶液吸收二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法。其中阴阳膜组合循环再生机理如图,则下列有关说法错误的是
K2=5.6×l0_11
则下列有关说法正确的是
A.等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa)
B.NaHCO3和Na2CO3混合溶液中,一定存在c(Na+)+ c(H+)=c(OH-)+ c(HCO3-) +
C.a mol?L-1 HCN溶液与b mol?L-1 NaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则a一定大于b
D.冰醋酸中逐滴加水,则溶液的导电性、醋酸的电离度、pH均先增大后减小
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com