
16.(10分) 随着经济发展和人民生活水平的提高,近年来我省汽车拥有量呈较快增长趋势。
⑴ 乙丙橡胶(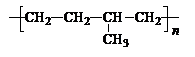 )因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
)因柔韧性好而被用于制造汽车门窗密封胶条,工业生产乙丙橡胶的单体是
。
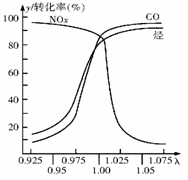 (2) 在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电 化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是
。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为
。
(2) 在发动机和三元催化转化器间的尾气流中安装一个称为λ探测器的电 化学元件,可测定λ(λ=入口处的空气量/完全燃烧需要的空气量)值,如右图所示。当汽车速度增加时,入口处的空气量增大,此时排出尾气中的主要污染物是
。在转化器的前半部,一氧化碳和氮氧化物(NOx)通过催化剂发生反应转化为无污染的气体,其反应的化学方程式为
。
(3)测定汽车尾气中NO,NO2的方法之一,用3%的H2O2溶液吸收生成HNO3,再用NaOH标准溶液滴定。若要确定尾气中NO,NO2体积分数总和,所需的数据有___________(选填序号)。
A.气体样品的体积
B.NaOH标准溶液的浓度及所消耗的体积
C.从滴定开始到指示剂变色所需的时间
D.两种氮氧化物的体积比
(4)为了降低汽车尾气对大气的污染,有关部门拟用甲醇替代作为公交车的燃料。写出用合成气(CO和H2)生产甲醇的化学方程式__________________________,用该方法合成甲醇的最大优点是______________________________________________。已知甲醇燃烧热为726kJ/mol。请写出甲醇燃烧的热化学方程式 。
15.(Ⅰ)下列实验操作或对实验事实的描述正确的是 (填序号);
① 实验室配制氯化亚铁溶液时,将氯化亚铁先溶解在盐酸中,然后用蒸馏水稀释并加入少量铁粉。
② 配制一定浓度的溶液时,俯视容量瓶的刻度线,会使配制的浓度偏高;实验室测定中和热时,过早读数会使测定结果偏低。
③ 将Fe2(SO4)3溶液加热蒸发至干并灼烧,最后得到红棕色粉末
④ 实验室用铜片与稀硝酸反应产生的气体可用排水法收集
⑤ 试管中加入少量淀粉,再加入一定量稀硫酸,加热3-4分钟,然后加入银氨溶液,片刻后管壁上有“银镜”出现
⑥ 向氨水中滴加Al2(SO4)3溶液和向Al2(SO4)3溶液中滴加氨水现象相同
⑦ 苯与溴水在铁粉的催化作用下制备溴苯
⑧ 分别向体积和pH均相同的盐酸和醋酸中滴加等浓度的氢氧化钠溶液,完全中和时消耗的氢氧化钠溶液的体积一样多
(Ⅱ).在中学化学实验中,通常用无水硫酸铜来检验少量水的存在。由于无水硫酸铜吸湿性很强,需要现制现用。
方法甲:取2药匙细小的硫酸铜晶体置于_______中研碎后放入坩埚,将坩埚放在______上用小火慢慢加热并用玻璃棒不停搅拌,最后将坩埚移入___________中进行冷却(请选用合适仪器填空:表面皿、研钵、烧杯、通风橱、试管夹、干燥器、泥三角)。
方法乙:取2药匙研碎的硫酸铜晶体于小烧杯中,加入20 mL浓硫酸(质量分数不低于98%),并用玻璃棒搅拌,静置5 min后倾去浓硫酸,用无水乙醇洗涤数次,倒在滤纸上晾干。
[交流与讨论]
(1)方法甲中,加热温度稍高时会出现变黑现象,原因是_________ (用化学方程式表示)。
(2)方法乙中,浓硫酸的作用是__________;为了不浪费药品,对无水乙醇洗涤液进行再生的方法是__ ,所用的主要玻璃仪器有蒸馏烧瓶、接液管、锥形瓶、酒精灯________________等。
(3)用制得的无水硫酸铜检验某双氧水中是否含水时,除了发现固体变蓝外,还发现该双氧水中有气泡产生,对此你有何猜想______________ 。
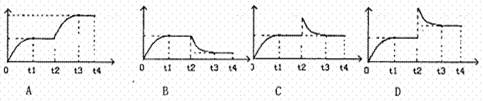
14.如图所示为一恒压容器。在恒定温度下,将1moIN2和3moIH2混合后由A口快速充入容器,封闭A。反应N2+3H2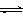 2NH3,在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,关闭A,
t3重新达平衡至t4。在0--t4时间内混合气中NH3的体积分数(纵坐标)随时间:(横坐标)变化的曲线正确的是
2NH3,在t1时刻达到平衡,t2时刻再从A口快速充入一定量NH3,关闭A,
t3重新达平衡至t4。在0--t4时间内混合气中NH3的体积分数(纵坐标)随时间:(横坐标)变化的曲线正确的是
第II卷
(非选择题共72分)
13.常温下,下列各溶液的叙述中正确的是
A.0.1mol/L的醋酸钠溶液20mL与0.1mol/L盐酸10mL混合后溶液显酸性
c (CH3COO-)>c (Cl-)>c (H+)>c (CH3COOH)
B.pH=7的醋酸钠和醋酸混合液中:c(Na+)= c(CH3COO-)
C.0.1mol/L的醋酸的pH=a,0.01mol/L的醋酸的pH=b,则a+1>b
D.已知酸性HF>CH3COOH,pH相等的NaF与CH3COOK溶液中,
 [c(Na+)-c(F一)]<[c(K+)-c(CH3COO一)]
[c(Na+)-c(F一)]<[c(K+)-c(CH3COO一)]
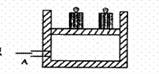
12.市场上有一种用于预防和治疗缺氧症状的便携式制氧器,利用过碳酸钠固体A(化学式为2Na2CO3·3H2O2)和灰黑色固体B(不溶于水)与水混合反应制得氧气。某同学对A、B两种物质进行探究,实验步骤及现象如下图所示。下列说法错误的是
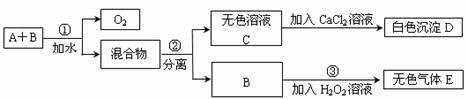
A.在反应①中可能起催化作用 B.设计③的目的是制取氧气
C.第②步分离混合物的方法是过滤 D.白色沉淀D为CaCO3
11.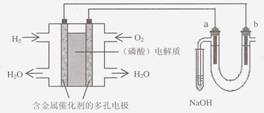 用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
用酸性氢氧燃料电池电解苦卤水 (含Cl―、Br―、Na+、Mg2+)的装置如图所示 (a、b为石墨电极)。下列说法中,正确的是
A.电池工作时,正极反应式为:O2 +2 H2O + 4e-=4 OH―
B.电解时,a 电极周围首先放电的是Br―而不是Cl―,说明当其它条件相同时前者的还原性强于后者
C.电解时,电子流动路径是:负极→外电路→阴极→溶液→阳极→正极
D.忽略能量损耗,当电池中消耗0.02g H2 时,b 极周围会产生0.02g H2
10.西维因是一种高效低毒杀虫剂,在一定条件下可水解:
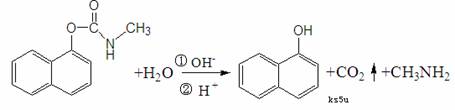
有关说法正确的是
A.西维因分子式为C12H10NO2
B.反应后经酸化,可用FeCl3溶液检验是否发生水解
C.1mol西维因最多能与6mol氢气发生加成反应
D.西维因分子中至少有21个原子共平面
9.下列离子方程式书写不正确的是
A.FeSO4溶液中加入H2O2:2Fe2++H2O2+2H+=2Fe3++2H2O
B.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
C.向NaOH溶液中滴加同浓度过量的Ca(HCO3)2溶液:
Ca2++ 2HCO3-+2OH-=CaCO3↓+ CO32-+2H2O
D.铜与浓硫酸反应放出SO2:Cu+4H++SO42-=Cu2++SO2↑+2H2O
8.将质量为m g的铁粉与铜粉的混合物,溶于100mL 4mol·L-1 HNO3溶液(过量),充分反应后所得还原产物为0.05mol NO,再向所得溶液中加入足量的NaOH溶液至沉淀完全,则沉淀质量为
A.5.52g B. (m+6.8)g C.(m+2.55)g D.(m+12.0)g
7.下列实验装置设计正确,且能达到目的的是
|
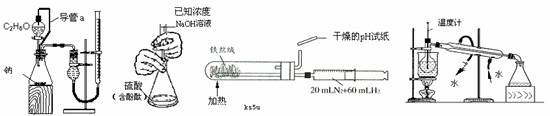
测定乙醇结构式 滴定法测定硫酸 合成氨并检验氨的生成 碘的CCl4溶液中分离I2
的物质的量的浓度 并回收CCl4
A B C D
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com