
8.相同条件下,向100mL pH=1的硫酸、醋酸、盐酸溶液中分别加入0.46g Na,产生氢气的体积分别为V1、V2、V3,则下列关系中,正确的是
A.V3<V2<V1 B.V1=V2=V3 C.V1=V3>V2 D.V1=V3<V2
7.某溶液中可能存在Br-、CO32-、SO32-、Al3+、I-、Mg2+、Na+等7种离子中的几种。现取该溶液进行实验,得到如下现象:
①向溶液中滴加足量氯水后,溶液变橙色,且有无色气泡冒出;
②向所得橙色溶液中加入足量BaCl2溶液,无沉淀生成;
③向所得溶液中继续滴加淀粉溶液,溶液不变蓝色。
据此可以推断:该溶液中肯定不存在的离子是
A.Al3+、Mg2+、I-、SO32-  B.Mg2+、Na+、CO32-、I-
B.Mg2+、Na+、CO32-、I-
C.Al3+、Na+、SO32-、I- D.Al3+、CO32-、Br-、SO32-
6.14g铜、银合金与足量的某浓度的硝酸反应,将放出的气体与1.12L(标准状况下)氧气混合,通入水中恰好全部被吸收,则合金中铜的质量为
A.9.6g B.6.4g C.3.2g D.1.6g
5. 下列化学用语表示错误的是
下列化学用语表示错误的是
4.近年来,我国储氢碳纳米管研究获重大进展,电弧法合成的碳纳米管,常伴有大量的碳纳米颗粒生成。这种碳纳米颗粒可用氧化气化法提纯。其反应的离子方程式为(其中a、b、c、d、e 、f为反应的系数):a C + b Cr2O72- + c H+ = d CO2↑ + e Cr3+ + f H2O。有关上述反应的叙述中正确的是
A.当a = 3时,e = 2
 B.反应中既可用稀硫酸又可用浓硝酸酸化
B.反应中既可用稀硫酸又可用浓硝酸酸化
C.系数b、c、e有如下关系:3e = 2b + c
D.若产生11 g气体物质,则有6.02×1023个电子发生转移
3.2008年度诺贝尔化学奖授予在绿色荧光蛋白(GFP)的研究和应用方面做出突出贡献的科学家。GFP是一个分子量较小的蛋白,最初是在水母中发现的,它可用于标记蛋白。以下关于GFP的说法正确的是
A.不属于天然有机高分子化合物 B.甲醛可使其变性
C.与强酸、强碱不反应 D.不能发生水解反应
2.火箭一般使用的动力材料是四氧化二氮和偏二甲肼(C2H8N2),C2H8N2遇N2O4后能自燃:C2H8N2+2N2O4=3N2+4H2O+2CO2
。但使用这种材料的火箭发射中对环境会产生诸多污染,下面对可能造成的污染的分析中不正 确的是
确的是
A.不完全燃烧时会产生CO
B.可能是排出的NO2会破坏臭氧层
C.可能是燃烧产生的CO2会形成酸雨
D.可能是剩余的燃料或氧化剂有毒而污染大气
1.不久前,日本某一材料研究所的科学家发明了一种“碳纳米管温度计”,这种温度计被认定为世界上最小的温度计。研究人员在长约10-6m,直径为10-7m的碳纳米管中充入液态的金属镓。当温度升高时,管中镓就会膨胀,通过电子显微镜就能读取温度值。这种温度计测量的范围可从18℃到490℃,精确度较高,所以它可用于检查电子线路是否异常,测量定毛细血管的温度等许多方面。根据以上信息判断下列推测中不正确的是
A.碳纳米管的体积在10℃至500℃之间随温度变化很小,可忽略不计
B.金属镓的体积在10℃至500℃之间随温度变化很小,可忽略不计
C.金属镓的体积在30℃至500℃之间随温度变化比较均匀
D.金属镓的熔点很低,沸点很高
20、(15 分)如下图装置所示,C、D、E、F、X、Y都是惰性电极,甲、乙中溶液的体积和浓度都相同(假设通电前后溶液体积不变),A、B为外接直流电源的两极。将直流电源接通后,F极附近呈红色。
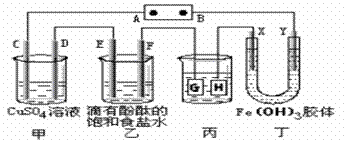
请回答:
(1)B极是电源的 极,一段时间后,甲中溶液颜色 ,丁中X极附近的颜色逐渐变浅,Y极附近的颜色逐渐变深,这表明 在电场作用下向Y极移动。
(2)电解一段时间内甲、乙装置中的C、D、E、F电极均分别只有一种单质生成时,对应单质的物质的量之比为 ,乙中发生反应的离子方程式为 ,若要使电解后的甲装置中的溶液恢复到原浓度则需加入一定量的 。(填物质的化学式)
(3)现用丙装置给铜件镀银,则H应该是 (填“镀层金属”或“镀件”)。当乙中溶液的pH是13时(此时乙溶液体积为500mL),丙中镀件上析出银的质量为 ,甲中溶液的pH (填“变大”、“变小”或“不变”)。
(4)若将C电极换为铁,其他装置都不变,则甲中发生总反应的离子方程式是 。
19、(1)(3分)下列反应在210℃达到平衡:
PCl5(气) PCl3(气)+Cl2(气); △H >0 K=1
①
PCl3(气)+Cl2(气); △H >0 K=1
①
CO(气)+Cl2(气) COCl2(气);△H<0 K=5×104
②
COCl2(气);△H<0 K=5×104
②
COCl2(气) CO(气)+ Cl2(气);△H >0
③
CO(气)+ Cl2(气);△H >0
③
(1) 反应②和反应③的K值表达式 (填“相同”或“不同”)
(2) 降低Cl2浓度,反应③的K值 (填“增大”、“减少”或“不变”)
(3) 要使反应①和反应②的K值相等,应采取的措施是
(a)反应①、反应②同时升高温度
(b)反应①、反应②同时降低温度
(c)反应①降低温度, 反应②维持210℃
(2)(10分)现将水蒸汽和CO气体分别通入到体积为1L的恒容密闭容器中进行反应。H2O(g)+CO(g)  CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
CO2(g)+H2(g);△H。得到以下三组数据,据此回答下列问题:
|
实验组 |
温度 |
起始量 |
平衡量 |
达到平衡所需时间 |
||
|
H2O |
CO |
H2 |
CO2 |
|||
|
1 |
650℃ |
1mol |
2mol |
0.8mol |
0.8mol |
5min |
|
2 |
900℃ |
0.5mol |
1mol |
0.2mol |
0.2mol |
3min |
|
3 |
900℃ |
a mol |
b mol |
c mol |
d mol |
t |
(1)由以上数据,实验1中以v(CO2)表示的反应速率为 mol·L-1·min-1。
(2)比较该反应实验1和实验2中CO的转化率:
 ;该反应的反应热△H
;该反应的反应热△H
0。(两空填“>”、“=”或“<”)
(3)若实验3要达到与实验2等效的平衡状态,且t<3 min,则a、b应满足的关系是 ,实验3条件时反应的平衡常数为 。
(4)900℃时,若要重新达到平衡,使c(CO2)/c(CO)比值变小,在其他条件不变时,可采取的措施有(填字母) 。
A.使用高效催化剂 B.增大H2浓度 C.升高温度 D.缩小容器体积
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com