
8.设NA表示阿伏加德罗常数的值,下列说法正确的是( )
A.17 g氨气所含质子数目为1NA
B.2.4 g金属镁变成镁离子时失去的电子数目为0.1NA
C.在标准状况下,22.4 L氧气中所含的氧原子数目为1NA
D.在25 ℃,压强为1.01×105 Pa时,28 g氮气所含的分子数目为NA
7.有科学家提出硅是“21世纪的能源”、“未来的石油”的观点。假如硅作为一种普遍使用的新型能源被开发利用,关于其有利因素的下列说法中,你认为不正确的是( )
A.硅便于运输、贮存,从安全角度考虑,硅是最佳的燃料
B.自然界中存在大量单质硅 C.自然界硅的贮量丰富
D. 硅燃烧放出的热量大,且燃烧产物对环境污染程度低,容易有效控制
21.选做题,共计12分。本题有A、B两题,分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,每题12分。请选择其中一题作答,并把所选题目对应字母后的方框涂黑。若两题都作答,将按A题评分。
A.下表是元素周期表的一部分。表中所列的字母分别代表某一种化学元素。
|
Z |
|
|
|
|
|||||||||||||
|
|
|
M |
L |
Q |
R |
|
|
||||||||||
|
D |
A |
|
|
T |
X |
Y |
|
||||||||||
|
E |
|
|
|
|
|
|
|
|
J |
|
|
|
|
|
|
|
|
(1)Y分别与D、E形成的化合物中熔点较高是_________(用化学式表示);T、X、Y原子的第一电离能由小到大的顺序是__________________(用元素符号表示)。
(2)LX2分子的电子式是_________,XY2分子是_________(填“极性分子”或“非极性分子”);QY3分子中Q采用_________杂化。
(3)由J、L、R三种元素形成的某种配位化合物,常温下该化合物具有挥发性,化学式为J(LR)4,其中J的化合价是0价。则基态J原子的核外电子排布式是__________________;与配体粒子互为等电子体的离子是_________;J(LR)4固态时属于_________晶体(填晶体类型)
 (4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式__________________。
(4)由Z、L、Q三种元素组成的化合物,分子式为Z9L3Q,它有多同分异构体(其中Q以三个单键与其它原子相连),写出其中沸点最低的物质结构简式__________________。
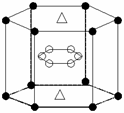
(5)A与M组成的一种化合物AM2,刷新了金属化合物超导 温度的最高记录。右图中所示的是该化合物的晶体结构单元。图中上下底面中心“Δ”处的原子是__________________(填元素符号)。
B.已知胆矾在不同温度下可以逐步失水:
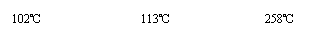
CuSO4·5H2O--→CuSO4·3H2O--→CuSO4·H2O--→CuSO4
某课外活动小组准备用浓硫酸和铜片为主要原料制取少量胆矾,其主要步骤有:①取少量铜片放在干燥的蒸发皿内,用酒精灯灼烧到其表面变黑为止;②向蒸发皿内加入一定量浓硫酸并加热,反应结束后发现有少量黑色固体及白色固体存在;③将上述冷却后的反应混合物用水稀释得蓝色溶液,白色固体消失,但仍有黑色固体存在;④向稀释后的所得溶液中加入过量碱式碳酸铜[Cu2(OH)2CO3],充分搅拌;⑤过滤,弃去不溶物;⑥将滤液转回洗净的蒸发皿内,用沸水浴缓缓加热蒸发,浓缩至表面有晶膜析出时为止,取下蒸发皿使溶液冷却,析出蓝色晶体。
(1)步骤⑤中要用到的玻璃仪器有 。
(2)步骤④中发生反应的离子方程式是 。
(3)简述步骤③的具体操作方法 。
(4)下列叙述错误的是 (有错选得“0”分)
A、将铜片灼烧,可以减少浓硫酸的消耗量。
B、用浓硫酸溶解灼烧后的铜片时,应在通风橱中进行。
C、步骤②中得到的黑色固体是CuO。
D、步骤②中得到的白色固体是CuSO4。
E、步骤⑥中为加快蒸发速度,也可用酒精灯直接给蒸发皿加热。
中学试卷网2009年高考押题卷
20.(10分)一般情况下,较强的氧化剂如:MnO2、KMnO4、KClO3、Ca(ClO)2等氧化浓盐酸时,有如下反应规律:氧化剂+浓盐酸→金属氯化物+水+氯气。实验室通常用该原理制取少量Cl2。
(1)从原子经济学角度出发,要使浓盐酸中Cl-充分转化为Cl2,制取等量的Cl2最好选用上述氧化剂中的(填化学式)____________________________氧化浓盐酸。
(2)将214.5gCa(ClO)2放入500mL、12.0mol/L的浓盐酸中,生成的Cl2在标准状况下的体积为39.2L。若反应前后溶液的体积保持不变,计算反应后溶液中HCl的物质的量浓度(写出必要的计算过程)。
(3)漂白粉是Ca(ClO)2、CaCl2·Ca(OH)2·H2O和CaO的混合物。漂白粉放出的氯气具有漂白性,叫做有效氯。漂白粉中的有效氯含量常用滴定碘法进行测定,即在一定量的漂白粉中加入过量的KI,加H2SO4酸化,有效氯与I-作用析出等量的I2,析出的I2以淀粉指示剂立即用Na2S2O3标准溶液滴定。
若测定漂白粉中有效氯时用盐酸酸化,你认为是否需要控制盐酸的浓度?________(填“需要”、“不需要”)。说明选择的理由。
19.(14分)已知:
R1-CHO+R2-CH2CHO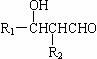
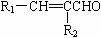
呋喃丙胺是一种临床上广泛使用的高效麻醉剂,也可用于治疗心律失常。由常见化工原料呋喃甲醛合成呋喃丙胺的流程如下:
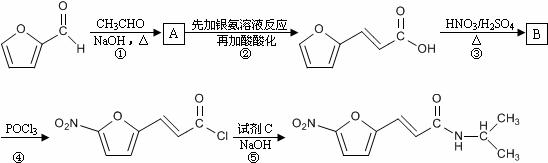
试回答下列问题:
⑴物质A的结构简式为____________________,反应①-⑤中属于取代反应的有___________(填序号)。
⑵呋喃甲醛中分子的核磁共振氢谱图上共有________个吸收峰,各吸收峰的面积比为_______________。
⑶呋喃丙烯酸具有多种同分异构体,其中属于醛类且含有酚羟基的同分异构体共有_______种。
⑷反应③的化学方程式为______________________________________。
⑸反应⑤在生成呋喃丙胺的同时,还有HCl生成,则试剂C的分子式为___________。
⑹有同学建议,为降低生产成本,反应②改用酸性高锰酸钾溶液作氧化剂。简要评价此建议是否合理:______________________________________________________。
18.(8分)高纯超净特种气体主要用于制造半导体器件、化合物半导体、激光器、光导纤维、太阳能电池等。超纯硅化氢制备方法如下:(已知:常温下SiH4难溶于水,与稀硫酸不反应,乙醚沸点34.6℃)
①由下列两种方法制得SiH4
方法一:Mg2Si+4NH4ClSiH4+2MgCl2+4NH3
方法二:LiAlH4+SiCl4SiH4+AlCl3+LiCl
②除去SiH4中混有的杂质气体
请回答下列问题:
⑴对方法一的理解,有同学认为是NH4+水解产生H+,Mg2Si与H+反应生成SiH4,你认为该观点是否正确?并简述理由____________________________________________。
⑵将方法二的固体产物溶于水,只有一种物质能促进水的电离,则NaOH、Mg(OH)2、LiOH碱性由强到弱的顺序为_________________。
⑶两种方法制得的SiH4中均含有少量杂质,有同学提出用下列方法除去SiH4中的杂质,其中肯定不可行是____________。
a.用稀硫酸洗气 b.高温使杂质分解 c.低温分馏
⑷甲、乙、丙三同学在讨论SiH4制备方法的化学反应类型时发表如下观点,你认为正确的是__________。
a.甲同学认为两个反应均为氧化还原反应
b.乙同学认为两个反应中只有一个属于氧化还原反应
c.丙同学认为要判断是否属于氧化还原反应,还需要知道SiH4中各元素具体的化合价
17.(10分)无水AlCl3可用作有机合成的催化剂、食品膨松剂等。工业制备无水AlCl3的流程如下:
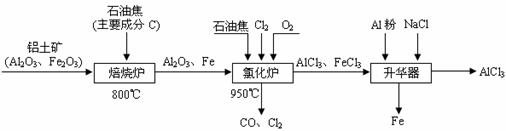
(1)已知:C(s)+O2(g)===CO(g) △H=-110.5kJ·mol-1
2Fe(s)+O2(g)===Fe2O3(s) △H=-822.1kJ·mol-1
请写出C还原Fe2O3生成CO的热化学方程式__________________________________。
(2)反应2CO+O2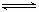 2CO2的平衡常数为K1;反应4Fe+3O2
2CO2的平衡常数为K1;反应4Fe+3O2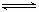 2Fe2O3的平衡常数为K2,则反应3CO+Fe2O3
2Fe2O3的平衡常数为K2,则反应3CO+Fe2O3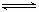 2Fe+3CO2的平衡常数K与K1、K2的关系式_______。
2Fe+3CO2的平衡常数K与K1、K2的关系式_______。
(3)氯化炉中生成的气体,通常用碱性的亚硫酸钠溶液来吸收,请用离子方程式分析亚硫酸钠溶液呈碱性的原因___________________________________。
(4)氯化炉中通入O2的目的是____________________________。
(5)沉淀分析法中一般规定:某离子物质的量浓度低于1.0×10-5mol·L-1时可以认为沉淀完全。现向一定浓度的AlCl3和FeCl3的混合溶液中滴加碱液,当Fe3+完成沉淀时,测定c(Al3+)=0.2mol·L-1。计算所得沉淀中是否含有Al(OH)3。(已知:Ksp[Fe(OH)3]=4.0×10-38,Ksp[Al(OH)3]=1.1×10-33)。
16. (8分)化合物A是由两种元素组成,其中-种是常见金属;化合物B是由三种元素组成的-种无色油状液体,B的相对分子质量为114;C是-种能使湿润的红色石蕊试纸变蓝的气体,B的氢核磁共振谱有两个蜂,F只有-个蜂,G相对分子质量为32。A-G有如F的转化关系:
(8分)化合物A是由两种元素组成,其中-种是常见金属;化合物B是由三种元素组成的-种无色油状液体,B的相对分子质量为114;C是-种能使湿润的红色石蕊试纸变蓝的气体,B的氢核磁共振谱有两个蜂,F只有-个蜂,G相对分子质量为32。A-G有如F的转化关系:
试回答下列问题:
(1)F的结构简式:_______________。
(2)B属-级自燃物品,若某石化厂发生B物质泄漏着火,正确的灭火方式是_________________________。
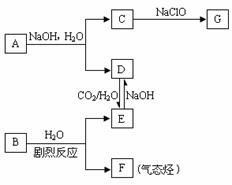
(3)G是-种易溶于水的二元弱碱,该分子的球棍模型为 ,它在水溶液中的电离方程式为___________________________________________。
,它在水溶液中的电离方程式为___________________________________________。
(4)D溶液中通入足量二氧化碳,反应的化学方程式为____________________________。
(5)G常用于锅炉除氧和除去金属污垢,如G可将热的氧化铜转变为氧化亚铜,该反应的化学方程式为____________________________。
15.(10分)某校学生为探究苯与溴发生反应的原理,用如图装置进行实验。
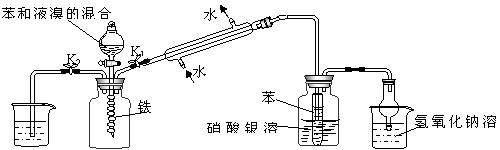
(I) (II) (III) (IV)
根据相关知识回答下列问题:
(1)实验开始时,关闭K2,开启K1和分液漏斗活塞,滴加苯和液溴的混合液,反应开始。过一会儿,在(Ⅲ)中可能观察的现象是 。
(2)实验装置中冷凝管的作用:①导气;②___________,提高原料的利用率,减小对后续实验的干扰。
(3)装置(Ⅲ)中的苯的作用除了能防止倒吸,还可以 __________。
(4)装置(IV)的作用_____________________________________________________。
(5)实验结束后,为了防止(II)中的气体污染空气,在拆除装置前,要把(I)中的水“灌”到(II)中,请简述这一操作方法_______________________________________。
14.工业上常用乙苯作原料生产苯乙烯,相关反应可表示如下(一般控制560℃时):
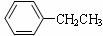 (g)
(g) 
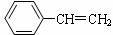 (g)+H2(g) ⊿H>0
(g)+H2(g) ⊿H>0
针对上述反应,在其它条件不变时,下列说法不正确的是
A.使用任何催化剂,都不可能提高乙苯的转化率
B.在保持体积一定的条件下,充入较多的乙苯,可以提高乙苯的转化率
C.仅从平衡移动的角度分析,工业生产苯乙烯选择恒压条件优于恒容条件
D.10.6t乙苯原料,在生产苯乙烯的同时可得副产品氢气0.2t
非选择题(72分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com