
1.下列物质的保存方法正确的是
①少量金属钠保存在冷水中 ②浓硝酸盛放在无色试剂瓶中
③少量金属钾保存在煤油中 ④氢氧化钠溶液盛放在带有橡胶塞的试剂瓶中
⑤氯水存放在带玻璃塞的无色细口瓶中 ⑥碳酸钠固体保存在带橡胶塞的细口瓶中
A.②③④ B.③④⑥ C.③④ D. ①③④
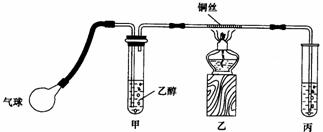
12、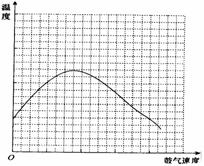 (15分)某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约l min后鼓入空气。请填写下列空白:
(15分)某课外活动小组利用如图所示的装置进行乙醇的催化氧化实验并制取乙醛(试管丙中用水吸收产物),图中铁架台等装置已略去。实验时,先加热玻璃管中的铜丝,约l min后鼓入空气。请填写下列空白:
(1)检验乙醛的试剂是 (2分)。
A.银氨溶液 B.碳酸氢钠溶液 C.新制氢氧化铜 D.氧化铜
(2)乙醇发生催化氧化的化学反应方程式为 (2分)。
(3)实验时,常常将甲装置浸在70-80℃的水浴中,目的是
由于装置设计上的缺陷,实验进行时可能会 (每空2分)。
(4)反应发生后,移去酒精灯,利用反应自身放出的热量可维持反应继续进行。进一步研究表明,鼓气速度与反应体系的温度关系曲线如图所示。试解释鼓气速度过快,反应体系温度反而下降的原因:
该实验中“鼓气速度”这一变量你认为可用 来估量(每空2分)。
(5)该课外活动小组偶然发现向溴水中加入乙醛溶液,溴水褪色。该同学为解释
上述现象,提出两种猜想:①溴水将乙醛氧化为乙酸;②溴水与乙醛发生加成反应。
请你设计一个简单的实验,探究哪一种猜想正确?
(3分)
11、(14分)已知①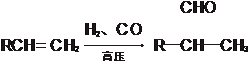
②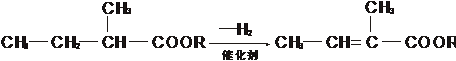
有机物A~F中,A与H2加成得到烷烃,经测定,该烷烃分子中只有两个-CH3,其一卤代物有两种同分异构体,C与X反应生成D。各物质之间的转化关系如图所示:
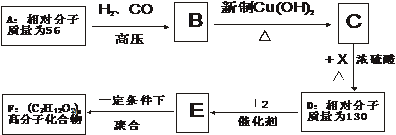
(1)写出X的结构简式: (2分)
(2)写出化合物A、E的结构简式:A: 、E (每空2分)
(3)写下列反应的类型C→D 、E→F (每空1分)
(4)写出B与足量新制氢氧化铜悬浊液共热时发生反应的化学方程式:
(3分)
(5)有机物G是有机物C不同类型的同分异构体,并且G能与金属钠发生应放出无色气体,又能发生银镜反应,又知G的同一类型的同分异构体共有多种,则其中只含有一个甲基的同分异构体的结构简式有:
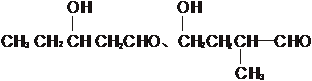
、 、 (每空1分)
10、(14分)A、B、C、X是中学化学常见物质,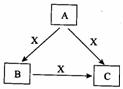 均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
均由短周期元素组成,转化关系如图所示。请针对以下三种不同情况回答:
(1)若A、B、C中均含同一种常见金属元素,该元素在C中以阴离子形
式存在,将A、C的水溶液混合可得B的白色胶状沉淀
①A中含有的金属元素为 (2分)。
②该金属元素的单质与某氧化物在高温下反应,可用于焊接铁轨及定向爆破,反应的化学反应方程式为 (2分)。
(2)若A为固态非金属单质,A与X同周期,常温常压下C为白色固体,B分子中各原子最外层均为8e-结构。
①B的电子式为 (2分)。
②C与水剧烈反应,生成两种常见酸,反应的化学方程式为 (2分)。
(3)若A、B、C的焰色反应均呈黄色,水溶液均为碱性。
①A中所含有的化学键是 、 (每空1分)。
②将4.48 L(标准状况下)X通入100mL 3 mol/L A的水溶液后,溶液中离子浓度由大到小的顺序为 (2分)。
③自然界中存在B、C和H2O按一定比例结晶而成的固体。取一定量该固体溶于水配成100mL溶液,测得溶溶中金属阳离子的浓度为0.5 mol/L。若取相同质量的固体加热至恒重,剩余固体的质量为
(2分)。
︱
9、(17分)元素X、Y、Z、W均为短周期元素,且原子序数依次增大。已知Y原子最外层电子数占核外电子总数的3/4,W-、Z+、X+半径逐渐减小,化合物XW常温下为气体,Z是本周期中除稀有气体元素外,原子半径最大的元素,据此回答下列问题:
(1)W在元素周期表中的位置: ,工业上生产W单质的离子方程式为: (每空2分)
(2)A、B均为由上述四种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1:1:1。若A能抑制水的电离,而B能促进水的电离,则A、B的化学式分别为 、 (每空2分)。
(3)C是由上述四种元素的两种组成的一种含有非极性键的离子化合物,则C的电子式为
(2分)。
(4)用B在碱性条件下可以处理CN-的工业废水,请将下列6种微粒:CN-、CO32-、N2、OH-、B的阴离子,W的阴离子,分别填入在下对应的横线上,组成一个配平的离子方程式(7分,每空1分)。
+ + ═ + + + H2O
8、X+、Y+、M2+、N2-是均含若干个电子的短周期元素的简单离子,离子半径大小关系:N2->Y+、Y+> X+、Y+> M2+、M2+> X+,下列比较中正确的是( )
A.原子半径:N可能比Y大,也可能比Y小 B.M2+、N2-核外电子数相等
C.原子系数:N>M>X>Y D.M(OH)2>Y OH
7、设阿伏加德罗常数为NA。则下列说法正确的是( )
A.0.1 mo1·L-1稀硫酸100mL中含有硫酸根的个数为0.1NA
B.1 cm3铁所含的铁原子数是ρNA/56(ρ是铁的密度,单位为g·cm-3)
C. 2.24L CO2与足量的Na2O2转移的电子总数为0.1NA
D.常温下,2.7g 铝片投入足量的浓硫酸中,铝失去的电子数为0.3NA
6、某温度下,在一容积可变的恒压密闭容器里,反应
3A(g)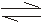 B(g)+3C(g) 达到平衡时,A、B和C的物质的量分别为
B(g)+3C(g) 达到平衡时,A、B和C的物质的量分别为
6 mol、2 mol、6 mol。在保持温度和压强不变的情况下,下列说法正确的是( )
A.将A、B、C各减少1 mol,C的百分含量减少
B.充入A、B、C各2 mol,平衡将向正反应方向移动
C.充入1 mol氦(He)(He与容器中气体不反应),平衡将向正反应方向移动
D.加入一定量的A气体达平衡后,C的百分含量一定增加
5、科学家从草莓中提取出一种天然类黄酮物质--非瑟酮(结构如图所示),
它可以提高记忆能力,下列有关它的说法正确的是( )
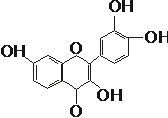 A.能与NaHCO3溶液发生反应生成CO2
A.能与NaHCO3溶液发生反应生成CO2
B.1 mol 非瑟酮能与5 mol Br2 发生取代反应
C.分子中所有碳原子一定处于同一平面
D.在酸性条件下,可发生水解
4、下列离子议程式书写正确的是( )
A.氟化钠溶于水:F--+H2O ═ HF+OH-
B.将氯气通入水中生成盐酸和次氯酸:Cl2+ H2O ═ 2H+ + Cl- + ClO-
C.用稀HNO3溶解FeS固体:FeS + 2H+ ═ Fe2+ + H2S↑
D.明矾溶液与等物质的量的氢氧化钡溶液混合:
3Ba2+ +6OH- + 2Al3+ + 3SO42- ═ 3BaSO4↓+ 2Al(OH)3↓
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com