
2. 经过圆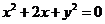 的圆心,且与直线
的圆心,且与直线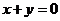 垂直的直线方程是( )
垂直的直线方程是( )
A. 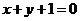 B.
B.
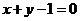
C. 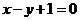 D.
D.
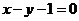
1. 函数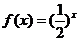 与函数
与函数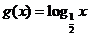 在
在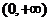 上的单调性为 ( )
上的单调性为 ( )
A.都是增函数
B.都是减函数
C.一个是增函数,另一个是减函数
D.一个是单调函数,另一个不是单调函数
28.(12分)
(1)abd ……………………………………………………………………………………2分
(2)①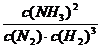 ………………………………………………………………2分
………………………………………………………………2分
②小 …………………………………………………………………………………2分
(3)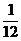 …………………………………………………………………………………3分
…………………………………………………………………………………3分
(4)ac …………………………………………………………………………………3分
27.(16分)
[实验方案]⑴ H2SO4(HCl)溶液、浓NaOH溶液 ………………………………2分
⑵ Cu2O ……………………………………………………………………………………2分
(3)N2 ……………………………………………………………………………………2分
[实验结论]
⑴ Cu(OH)2既能溶于盐酸,又能溶于浓NaOH溶液 ……………………………………2分
⑵+1价Cu比+2价Cu稳定 ……………………………………………2分
+2价Cu比+1价Cu稳定 ……………………………………………2分
[问题讨论]
取NH3与CuO反应后生成的红色物质少许,加入稀H2SO4,若溶液出现蓝色,说明红色物质中含有A,反之则无 ………………………………………………………………4分
(取样1分,操作1分,现象1分,结论1分)
26.(14分)
 (1)a c
……………………………………………………………………………………2分
(1)a c
……………………………………………………………………………………2分
 (2)2Fe2++H2O2+2H+=2Fe3++2H2O ………………………………………………………3分
(2)2Fe2++H2O2+2H+=2Fe3++2H2O ………………………………………………………3分
 (3)10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4
+ 6KCl + 8H2O ……………………………3分
(3)10KOH + 3Cl2 + 2Fe(OH)3 == 2K2FeO4
+ 6KCl + 8H2O ……………………………3分
(4)Fe(OH)3-3e-+5OH-=FeO42-+4H2O ……………………………………………3分
1 ……………………………………………………………………………………3分
25.(16分)
(1)-OH(羟基) …………………………………………………………2分
|
|
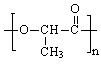 …………………………………………………………2分
…………………………………………………………2分
(3)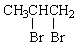 +2NaOH
+2NaOH
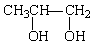 +2NaBr ……………………3分
+2NaBr ……………………3分
(化学方程式书写,反应条件1分,配平1分,化学式或结构简式写错1个扣1分。以下同)
(4)n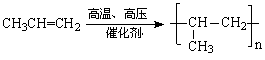 ………………………………3分
………………………………3分
(5)
|
|
|
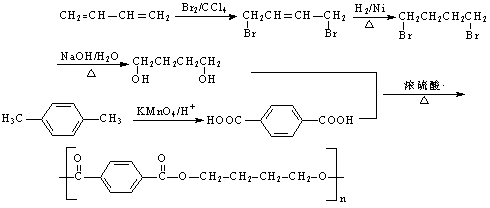 ……6分
……6分
(反应条件写错1个扣1分,结构简式少写、写错1个扣1分)
6.C 7.D 8.D 9.B 10.A 11.A 12.C
28.(12分)
合成氨工业在现代农业、国防工业中,有着重要的地位
已知:N2(g) + 3H2(g)
 2NH3(g) △H = -92 kJ·mol-1
2NH3(g) △H = -92 kJ·mol-1
(1)下列有关该反应速率的叙述,正确的是(选填序号) 。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,但可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2 置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。
(4)对于合成氨反应而言,下列有关图象一定正确的是(选填序号)_____________。
|
|
|
|
|
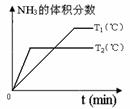
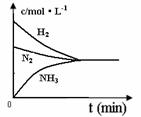
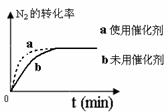
a. b. c.
说明: 合理答案均可酌情给分,但不得超过原题分数。
27.(16分)某校化学研究性学习小组在学习了金属的知识后,探究Cu的常见化合物性质。过程如下:
[提出问题]
① 在周期表中,Cu、Al位置接近。Cu不如Al活泼,Al(OH)3具有两性,Cu(OH)2也具有两性吗?
② 通常情况下,+2价Fe的稳定性小于+3价Fe,+1价Cu的稳定性也小于+2价Cu吗?
③ CuO有氧化性,能被H2、CO等还原,也能被NH3还原吗?
[实验方案]
⑴ 解决问题①需用到的药品有CuSO4溶液、 (填试剂),同时进行相关实验。
⑵ 解决问题②的实验步骤和现象如下:取98 g Cu(OH)2固体,加热至80 ℃-100 ℃时,得到黑色固体粉末,继续加热到1000 ℃以上,黑色粉末全部变成红色粉末A。冷却后称量,A的质量为72 g,A的化学式为 。向A中加入适量的稀硫酸,得到蓝色溶液,同时观察到容器中还有红色固体存在。
⑶ 为解决问题③,设计的实验装置为(夹持及尾气处理装置未画出):
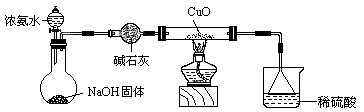
实验中观察到CuO变为红色物质。查资料可知,同时生成一种无污染的气体。
该气体的化学式为 。
[实验结论]
⑴Cu(OH)2具有两性。证明Cu(OH)2具有两性的实验现象是
。
⑵ 根据实验方案⑵,得出的+1价Cu和+2价Cu稳定性大小的结论是高温时 ;在酸性溶液中 。
⑶ CuO能够被NH3还原。
[问题讨论]
有同学认为NH3与CuO反应后生成的红色物质是Cu,也有同学认为NH3与CuO反应后生成的红色物质是Cu和A的混合物。请你设计一个简单的实验检验NH3与CuO反应后生成的红色物质中是否含有A?
26.(14分)E和M均为生活中常见的金属元素。现有如下反应关系:
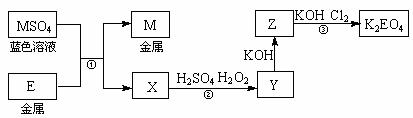
 (1)反应①的反应类型是____________________(填序号)。
(1)反应①的反应类型是____________________(填序号)。
a.氧化还原反应 b.复分解反应 c.置换反应
 (2)Y的溶液可使KSCN溶液显红色。反应②的离子方程式是____________________。
(2)Y的溶液可使KSCN溶液显红色。反应②的离子方程式是____________________。
 (3)K2EO4为高效绿色净水剂,可通过反应③制得。反应③的化学方程式是
(3)K2EO4为高效绿色净水剂,可通过反应③制得。反应③的化学方程式是
____________________。
(4)用K2EO4和Zn作原料的电池是一种新型可充电电池,该电池长时间保持稳定的放电电压。其总反应可写成:3Zn+2K2EO4+8H2O 3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
3Zn(OH)2+2E(OH)3+4KOH,则充电时的阳极反应是
。放电时消耗32.5 g Zn时转移 mol电子。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com