
5.-Hey, did you enjoy the vacation in London?
-No.Our vacation was totally ruined; not only was the food terrible but the weather was awful .
A.in the meanwhile B.as well
C.as a matter of fact D.in addition
4.Without the contributions of Qian Xuesen, the father of Chinese missile, the achievements in space technology unthinkable in China.
A.would be B.would have been
C.might be D.should have been
3.With the price of pork and eggs quickly, CPI has become a hot phrase among Chinese.
A.climbing B.climbed C.to climb D.climb
2.In 18-minute address to students across America on September 8, 2009, President Obama told American students to make most of their education.
A.an; the B.an; a C.the; the D.the; a
第一节:单项填空(共20小题;每小题0.5分,满分10分)
从每题所给的A、B、C、D四个选项中,选出可以填入空白处的最佳选项,并在答题卡上将该项涂黑。
1.-Tony, I really appreciate your wonderful performance in the concert.
-_________.
A.I've practiced for ages B.Well, it's just so-so
C.No, I don't think so D.Thank you very much
1.(B)(1)c; e; b。 (2)a; b。 (3)蒸发; 过滤。
2(1)用导管将A的上口和B相连(或将A换成恒压滴液漏斗);在G和H之间增加干燥装置。 (2)MnO2+4H++2Cl-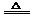 Mn2++Cl2↑+2H2O; 2S+Cl2
Mn2++Cl2↑+2H2O; 2S+Cl2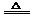 S2Cl2。
S2Cl2。
(3)饱和食盐水(或水)、浓硫酸。
(4)分液漏斗、蒸馏烧瓶;导气、冷凝。
(5)产率降低(或S2Cl2分解);有固体产生。(或其他正确描述)
(6)SCl2、Cl2、S(任写其中两种即可);控制浓盐酸的滴速不要过快。
 3
3  (1)MnO2 + 4H+ + 2Cl-
(1)MnO2 + 4H+ + 2Cl-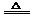 Mn2+ + Cl2↑ + 2H2O
Mn2+ + Cl2↑ + 2H2O (2)平衡压强 浓硫酸 使SiCl4 冷凝
(2)平衡压强 浓硫酸 使SiCl4 冷凝 (3)Al、P、Cl
(3)Al、P、Cl (4)①否;KMnO4溶液自身可作指示剂;
(4)①否;KMnO4溶液自身可作指示剂; ②4.480%
②4.480%
4 (1)MnO2+2FeSO4+2H2SO4=MnSO4+Fe2(SO4)3+2H2O。
(2)Fe(OH)3、Al(OH)3。 (3)Cu2+、Zn2+。
(4)MnO2+H2O+e-=MnO(OH)+OH-(或2MnO2+H2O+2e-=Mn2O3+2OH-)
(5)锌、二氧化锰。
5(1)关闭活塞K,将末端导管插入试管A的水中,用酒精灯微热硬质试管,若末端导管有连续均匀的气泡冒出,撤去酒精灯冷却一段时间,在导管内形成一段水柱,并且一段时间不回落,则证明装置的气密性良好。
(2)反应过程中末端导管必须始终插入试管A的水中,目的是:防止空气中的氧气通过末端导管进入实验装置,氧化单质钙,生成氧化钙,引入杂质。
(3)反应结束后,先将末端导管从试管A中拔出,再熄灭酒精灯。
(4)x=2.8;因为钙的总量不变,若通入的N2中混有少量O2,所得产物中会混有氧化钙,因为氮的相对原子质量小于样的相对原子质量,结果m2偏大,n(N)会偏大,所以x值会减小。
 6(1)B
6(1)B  (2)防止NH4HCO3分解(或减少Fe2+的水解)
(2)防止NH4HCO3分解(或减少Fe2+的水解)
 (3)降低K2SO4 的溶解度,有利于K2SO4 析出。
(3)降低K2SO4 的溶解度,有利于K2SO4 析出。
 (4)2SO42- -2e-
(4)2SO42- -2e- 2S2O82-
2S2O82-
6. (8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:
(8分)以氯化钾和钛白厂的副产品硫酸亚铁为原料生产硫酸钾、过二硫酸钠和氧化铁红颜料,原料的综合利用率较高。其主要流程如下:

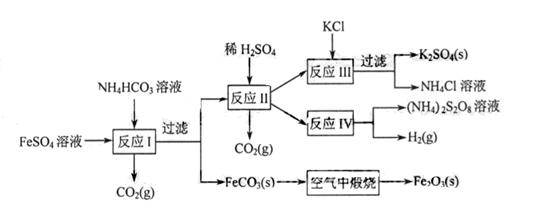
 (1)反应I前需在
(1)反应I前需在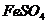 溶液中加入 (填字母),以除去溶液中的
溶液中加入 (填字母),以除去溶液中的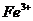 。
。
 A.锌粉 B.铁屑 C.KI溶液 D.
A.锌粉 B.铁屑 C.KI溶液 D.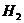
 (2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
(2)反应Ⅰ需控制反应温度低于35℃,其目的是
。
 (3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
(3)工业生产上常在反应Ⅲ的过程中加入一定量的醇类溶剂,其目的是
。
 (4)反应Ⅳ常被用于电解生产
(4)反应Ⅳ常被用于电解生产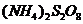 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
化学实验综合题答案
5.(12分) 某试验小组利用如下装置(部分固定装置略)制备氧化钙(Ca3N2),并探究其实验式。
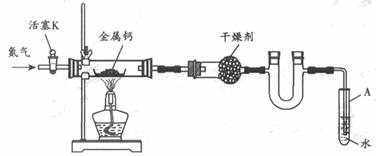
(1)按图连接好实验装置。检查装置的气密性,方法是 。
(2)反应过程中末端导管必须插入试管A的水中,目的是 。
(3)制备氮化钙的操作步骤是:①打开活塞K并通入N2;②点燃酒精灯,进行反应;③反应结束后, ;④拆除装置,取出产物。
(4)数据记录如下:
|
空瓷舟质量m0/g |
瓷舟与钙的质量m1/g |
瓷舟与产物的质量m2/g |
|
14.80 |
15.08 |
15.15 |
①计算得到实验式CaxN2,其中x= .
②若通入的N2中混有少量O2,请比较x与3的大小,并给出判断依据: 。
4.二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如下:
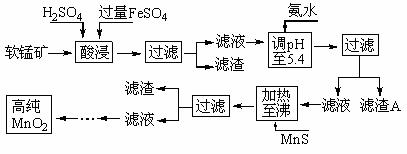
某软锰矿的主要成分为MnO2,还含有Si(16.27%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
|
沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
|
pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥-0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为_________________________。
(2)滤渣A的主要成分是_____________________________。
(3)加入MnS的目的是除去______________________杂质。
(4)碱性锌锰电池中,MnO2参与的电极反应方程式为
__________________________________。
(5)从废旧碱性锌锰电池中可以回收利用的物质有____________________________(写两种)。
3.(09浙江卷 28)(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
28)(15分)单晶硅是信息产业中重要的基础材料。通常用碳在高温下还原二氧化硅制得粗硅(含铁、铝、硫、磷等杂质),粗硅与氯气反应生成四氯化硅(反应温度450-500°C),四氯化硅经提纯后用氢气还原可得高纯硅。以下是实验室制备四氯化硅的装置示意图。
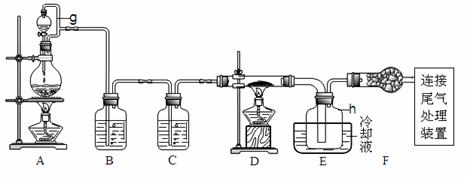

 相关信息如下:
相关信息如下:
 a.四氯化硅遇水极易水解;
a.四氯化硅遇水极易水解;
 b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
b.硼、铝、铁、磷在高温下均能与氯气直接反应生成相应的氯化物;
 c.有关物质的物理常数见下表:
c.有关物质的物理常数见下表:
|
物质 |
SiCl4 |
BCl3 |
AlCl3 |
FeCl3 |
PCl5 |
|
沸点/℃ |
57.7 |
12.8 |
- |
315 |
- |
|
熔点/℃ |
-70.0 |
-107.2 |
- |
- |
- |
|
升华温度/℃ |
- |
- |
180 |
300 |
162 |

 请回答下列问题:
请回答下列问题:
 (1)写出装置A中发生反应的离子方程式
。
(1)写出装置A中发生反应的离子方程式
。
 (2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
(2)装置A中g管的作用是
;装置C中的试剂是
;装置E中的h瓶需要冷却理由是
。
 (3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
(3)装置E中h瓶收集到的粗产物可通过精馏(类似多次蒸馏)得到高纯度四氯化硅,精馏后的残留物中,除铁元素外可能还含有的杂质元素是
(填写元素符号)。
 (4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:
(4)为了分析残留物中铁元素的含量,先将残留物预处理,是铁元素还原成Fe2+ ,再用KMnO4标准溶液在酸性条件下进行氧化还原滴定,反应的离子方程式是:

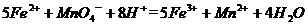
 ①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
①滴定前是否要滴加指示剂?
(填“是”或“否”),请说明理由
。
 ②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
②某同学称取5.000g残留物,预处理后在容量瓶中配制成100ml溶液,移取25.00ml,试样溶液,用1.000×10-2mol· L-1KMnO4标准溶液滴定。达到滴定终点时,消耗标准溶液20.00ml,则残留物中铁元素的质量分数是
。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com