
6.(8分)用一个“R×1”“R×10”“R×1 k”三个欧姆挡的多用表粗测一个未知电阻Rx的值,测量前经检查表针指在左端“0”位置,某同学先将选择开关拨到“R×10”量程上,并将两表笔短接,调整调零旋钮,使表针指在电阻刻度的零位置上,然后用两表笔分别与Rx两端相接,发现表针几乎不动,随后他进行了一系列操作,正确地测出了Rx的值.提供给你的操作步骤有:
A.将两表笔短接
B.根据表针指示读数
C.将选择开关拨到“R×1”挡
D.将选择开关拨到“R×1 k”挡
E.调节欧姆调零旋钮
F.将选择开关拨到OFF挡
G.将两表笔与电阻Rx两端相连接
H.将两表笔从测试笔插孔拔出
请将该同学正确测定Rx值的操作步骤按合理的顺序排列(无用的步骤不要排入).其顺序为________.
5.(8分)用伏安法测电阻.当被测电阻的阻值不能估计时可采用试接的办法,如图1-31-3所示,让电压表一端接在电路上的a点,另一端先后接到b点、c点,注意观察两个电表的示数.若安培表示数有显著变化,则待测电阻跟_______表的内阻可比拟,电压表应接在a_______两点;若电压表的示数有显著变化,则待测电阻跟_______表的内阻可比拟,电压表应接在a_______两点.
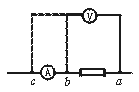
图1-31-3
4.除导线和开关外,下述各组器材可完成测定电源的电动势和内阻的是
A.电压表和电流表
B.电流表和电阻箱
C.电流表和变阻器
D.电压表和电阻箱
E.电压表和变阻器
F.电压表、电流表和变阻器
3.如图1-31-2所示电路的三根导线中,有一根是断的,电源、电阻器R1、R2及另外两条导线都是好的.为了查出断导线,某同学想先将万用表的红表笔连接在电源的正极a端,再将黑表笔分别接在电阻器R1的b端和R2的c端,并观察万用表指针的示数,在下列选挡中,符合操作规程的是
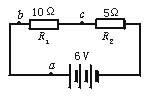
图1-31-2
A.直流10 V挡 B.直流0.5 A挡
C.直流2.5 V挡 D.欧姆挡
2.如图1-31-1所示是在同一坐标系中画出的a、b、c三个电源的U-I图象.其中a和c图线平行,正确的判断是
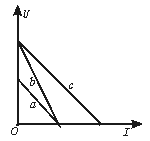
图1-31-1
A.Ea<Eb,ra=rb B. Eb = Ec,rc>rb
C. Ea<Ec,ra=rc D. Ea = Ec,rb=rc
1.某同学用伏安法测量电阻时,分别采用电流表内接法和外接法,测得某电阻Rx的阻值分别为R1和R2,则所测阻值与真实值Rx的关系应是
A.R1>Rx>R2 B.R1<Rx<R2
C.R1>R2>Rx D.R1<R2<Rx
27.答案解析:(难)在高温下,铁可与水蒸气发生反应,产物有Fe3O4和H2,产物Fe3O4可以与稀硫酸发生反应:Fe3O4+ 8H+══Fe2+ + 2Fe3+ + 4H2O。如果铁粉过量,还可发生:Fe+2Fe3+══3Fe2+,所以滤液中可能含有Fe3+,也可能不含Fe3+。检验溶液中含有Fe3+方法很多,最灵敏的方法是滴入几滴KSCN溶液,观察溶液颜色是否变红。Fe(OH)2不稳定,接触空气时很快被氧化成Fe(OH)3,要较长时间观察到白色沉淀的生成,关键是怎样降低反应体系中氧气的量,本题设计的装置能够成功地使Fe(OH)2长时间保持白色,关键在于用H2赶走了体系中的氧气。
27.(15分)常温下,在没有氧气存在时,铁与水几乎不反应,但高温下,铁能与水蒸气反应。
(1)铁粉与水蒸气反应的化学方程式是: 。
(2)停止反应,待装置冷却后,取出反应过的还原铁粉混合物,加入过量的稀硫酸充分反应,过滤。简述检验所得滤液中Fe3+的操作方法: 。
(3)经检验上述滤液中不含Fe3+,这不能说明还原铁粉与水蒸气反应所得产物中不含+3价的Fe元素。原因是(结合化学方程式说明) : 。
(4)某同学利用上述滤液制取白色的Fe(OH)2、沉淀,向滤液中加入NaOH溶液后,观察至生成的白色的沉淀迅速变成灰绿色,最后变成红褐色。
①沉淀由白色→红褐色的化学方程式是: 。
②为了得到白色的Fe(OH)2沉淀,并尽可能长时间保持其白色,有人设计如下图所示装置:
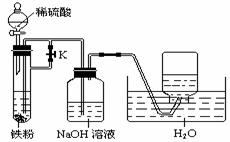
请简述实验操作及原理: 。
26.答案解析:(中难)该题是以NaNO2的性质为主题对氧化还原反应和离子反应的综合考查,要求学生能根据题目所给信息和要求,结合生活常识及有关物质发生氧化还原反应规律、配平规则,离子方程式书写技巧寻找结论,并规范作答。题中反应须在酸性条件下进行,生活中食醋显酸性。NaNO2→N2是一个还原过程,需加入还原剂才能实现。参考答案归纳如下:
(1)x:2(2分) y:4 (2分)
(2)食醋 (3分)(或醋,答醋酸不得分)
(3)c (2分) NH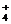 +NO
+NO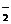 ══N2↑+2H2O (3分)
══N2↑+2H2O (3分)
技能空间: 第(1)小题可根据原子(碘原子)守恒来确定x的数值,由于I2的系数是1,所以前面的系数x=2,当然也可根据得失电子守恒来确定x的数值。然后根据氧原子守恒得z=2,再根据氢原子守恒得y=4,当然也可根据电荷守恒来确定y的数值。离子氧化还原反应方程式,除了要符合质量守恒、电子得失守恒,还要符合电荷守恒,即离子反应方程式等号左右两边离子所带电荷总数相等。
26.(12分)工业盐中含有NaNO2,外观和食盐相似,有咸味,人若误食会引起中毒,致死量为0.3g-0.5g。已知NaNO2能发生如下反应(方程式已配平):
2NO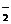 +xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
+xI-+yH+══2NO↑+I2+zH2O,请回答下列问题:
(1)上述反应中,x的数值是 ,y的数值是 。
(2)根据上述反应,可用化学试纸的生活中常见物质进行实验来鉴别工业盐和食盐,现有碘化钾淀粉试纸,则还需选用的生活中常见物质的名称为 。
(3)某工厂废切削液中含有2%-5%的NaNO2,直接排放会造成水污染,但加入下列物质中的某一种就能使NaNO2转化为不引起污染的N2,该物质是 ,
a.NaCl b.H2O2 c.NH4Cl d.浓H2SO4
所发生反应的离子方程式为: 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com