
4.一点光源S经平面镜M成像于S′,人眼于P点可以观察到的S′,如图1-41-2所示.今在S、M之间放一不太大的遮光板N,则
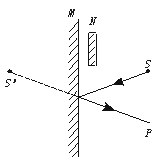
图1-41-2
A.S不能在M中成像 B.S仍能在M中成像
C.人眼观察到的S′的亮度变弱 D.人眼观察到的S′的亮度不变
3.如图1-41-1所示,a、b、c三条光线会聚于S点.若在S点前任意位置放一平面镜,则
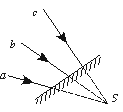
图1-41-1
A.三条反射光线可能交于一点,也可能不交于一点
B.三条反射光线一定不会交于一点
C.三条反射光线一定交于镜前一点
D.三条反射光线的延长线交于镜后一点
2.下列有关光反射的说法正确的是
A.平行光束射向物体表面,反射后可能不是一束平行光
B.在镜面反射中,光的反射遵守反射定律;在漫反射中,光的反射不遵守反射定律
C.电影银幕用粗糙材料,这是为了增加漫反射效果
D.两种介质的界面是一个平面,当光线垂直于界面从一种介质进入另一种介质时一定没有反射光线
1.当月球绕地球旋转时,正好转到太阳和地球之间,在地球上某些地方便发生日食.下列说法中正确的是
A.在月球背面的本影区地面上将发生日全食
B.在月球背面的半影区地面上将看到日偏食
C.发生日环食时月球距地球比发生日全食时月球距地球近一些
D.发生日环食时月球距地球比发生日全食时月球距地球远一些
29.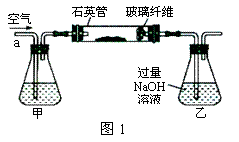 (18分) 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
(18分) 黄铁矿(主要成分为FeS2)是我国大多数硫酸厂制取硫酸的主要原料。某化学学习小组对某黄铁矿石进行如下实验探究。
[实验一]测定硫元素的含量。
Ⅰ、将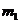 g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2
g该黄铁矿样品放入如图1所示装置(夹持和加热装置省略)的石英管中,从a处不断地缓缓通入空气,高温灼烧石英管中的黄铁矿样品至反应完全。石英管中发生反应的化学方程式为:4FeS2 + 11O2 2Fe2O3 + 8SO2。
2Fe2O3 + 8SO2。
Ⅱ、反应结束后,将乙瓶中的溶液进行如图2所示处理。
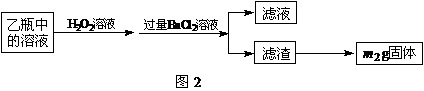
[实验二]测定铁元素的含量。
Ⅲ、测定铁元素含量的实验步骤如下:
①用足量稀硫酸溶解石英管中的固体残渣;
②加还原剂使溶液中的Fe3+完全转化为Fe2+后,过滤、洗涤;
③将滤液稀释至250 mL;
④取稀释液25.00 mL,用已知浓度的酸性KMnO4溶液滴定。
问题讨论:
(1) ①Ⅰ中,甲瓶内所盛试剂是 溶液。乙瓶内发生反应的离子方程式有:
、 。
②其中玻璃纤维的作用是___________________________________。
(2) Ⅱ中的滤渣在称量前还应进行的操作是 。
(3) Ⅱ中,所加H2O2溶液需足量的理由是 。
(4) Ⅲ的步骤③中,需要用到的仪器除烧杯、玻璃棒、胶头滴管外,还有 。
④中取稀释液25.00ml需用的仪器是 。
(5) 该黄铁矿中硫元素的质量分数为 。
28.(16分) 下图中X是一种具有水果香味的合成香料,E与FeCl3溶液作用显紫色。

根据上述信息回答:
(1) H中含氧官能团的名称是 ,B→I的反应类型为 。
(2) A的结构简式为 ;J的结构简式为 。
(3) 只用一种试剂鉴别D、E、H,该试剂是 。
(4) K与H互为同分异构体,且满足条件①链状化合物,②在酸性条件下能够水解;则K的可能结构简式有 种。
(5) 写出下列反应化学方程式
① D + F→X 。
② Y→I 。
27. (13分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(13分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
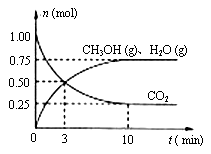
(1) 目前工业上有一种方法是用CO2来生产燃料甲醇。为探究该反应原理,进行如下实验,在体积为2L的密闭容器中,充入1molCO2和3.25molH2,在一定条件下发生反应,测定CO2、CH3OH和H2O(g)的浓度随时间变化如右图所示:
①写出该工业方法制取甲醇的化学方程式: 。
②从反应开始到平衡,氢气的平均反应速率v(H2)= 。
③反应到达平衡后,再向该容器中通入1 mol CO2和3.25 mol H2,重新到达平衡后,H2的转化率将 (填增大、减小或不变)
④下列措施中一定能使n(CH3OH)/ n(CO2)增大的是: 。
A.升高温度 B.充入CO2
C.将水蒸气从体系中分离 D.用更有效的催化剂
(2) 已知a g甲醇液体燃烧生成CO2和液态水时放热b kJ.
①表示甲醇燃烧的热化学方程式为: 。
②若利用以上反应,选用合适的合金作为电极,以氢氧化钠为电解质溶液,可以制成甲醇氧气燃料电池,此燃料电池负极反应式为
。
26.(13分) A、B、C、D、E是位于短周期的主族元素。已知:①热稳定性:HmD>HmC;②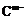 、
、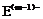 具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
具有相同的电子层结构;③A与B在同一周期,在该周期所有主族元素中,A的原子半径最大,B的离子半径最小;④A与B质子数之和是D质子数的3倍。依据上述信息用相应的化学用语回答下列问题:
(1) HmD的电子式:___________________。
(2)
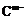 、
、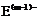 的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________。
的还原性强弱顺序为:_________,能证明其还原性强弱的离子方程式为_________________________________________________。
(3) 将E的单质通入A与D形成的化合物的水溶液中,其离子方程式为:
_______________________________________________________。
(4) 常温下,将等物质的量浓度的HmC溶液和A的最高价氧化物对应的水化物溶液等体积混合,所得溶液显碱性。该溶液中离子浓度由大到小的顺序为:____________________。
(5) 在A、B、C、E单质中,符合下列转化关系的是:___________(填元素符号)。
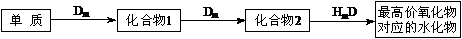
13.用惰性电极电解一定质量的某浓度的NaCl溶液,一段时间后停止电解。此时若加入100g 36.5%的浓盐酸,所得溶液正好与原溶液完全相同,则下列说法正确的是( )
A.电解过程中,两极所得到的气体,在相同的条件下体积相等
B.电解过程中,在相同的条件下,阳极所得到的气体的体积比阴极的大
C.电解过程中转移电子的物质的量约为8 mol
D.原某浓度的NaCl溶液中溶有117g NaCl
第Ⅱ卷 非选择题(共174分)
本卷共10个大题.
12.常温下,关于浓度均为0.1 mol/L的6种溶液:①氨水、②HCl、③NH4Cl、④NH4HSO4、⑤NaOH、⑥CH3COOH,下列说法错误的是( )
A.将6种溶液等体积混合,所得溶液恰好呈中性
B.①和③等体积混合后的溶液:c(NH4+)>c(Cl-)>c(OH-)>c(H+)
C.①和②等体积混合后的溶液:c(H+) = c(OH-) + c(NH3·H2O)
D.④和⑤等体积混合后的溶液:c(Na+) = c(SO42-)>c(NH4+)>c(H+)>c(OH-)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com