
4.影响①→②→③城市年均温差异的主要因素是 ( )
A.地形 B.海陆位置 C.太阳辐射 D.人类活动
3.⑥→⑤→④城市一月均温的变化体现了 ( )
A.从赤道向两极的地域分异规律 B.从沿海向内陆的地域分异规律
C.山地垂直地域分异规律 D.非地带性
2.温哥华西侧洋流对该地环境的影响是 ( )
A.增温减湿 B.减温减湿 C.增温增湿 D.减温增湿
表1中序号①至⑥为我国六个省会城市。回答3-6题。
表1 (单位:℃)
|
序号 |
一月均温 |
七月均温 |
年均温 |
序号 |
一月均温 |
七月均温 |
年均温 |
|
① |
-0.3 |
27.3 |
14.2 |
④ |
-2.9 |
26.6 |
12.7 |
|
② |
4.7 |
29.3 |
17.2 |
⑤ |
2.1 |
82.3 |
15.7 |
|
③ |
13.3 |
28.4 |
21.8 |
⑥ |
15.8 |
28.8 |
22.9 |
1.在当地时间2月14日16时30分开始进行的双人混合花样滑冰的比赛中,中国三对选手 表现出色。北京电视台开始现场转播此次比赛的时间是 ( )
A.14日18时30分 B.15日0时30分
C.14日23时30分 D.15日8时30分
2010.4
第I卷(单项选择题)
本卷共35小题,每小题4分,共140分。在每小题列出的四个选项中,只有一项是最符合题目要求的。
2010年冬季奥运会于2月12日至28日在加拿大的温哥华(西八区)举行。回答1、2题。
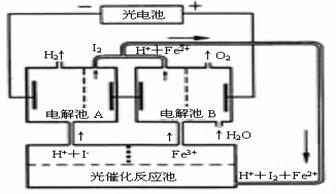
42.(2006年江苏卷(10分))利用太阳光分解水制氢是未来解决能源危机的理想方法之一。某研究小组设计了如右图所示的循环系统实现光分解水制氢。反应过程中所需的电能由太阳能光电池提供,反应体系中I2和Fe3+等可循环使用。
⑴写出电解池A、电解池B和光催化反应池中反应的离子方程式。
⑵若电解池A中生成3.36 L H2(标准状况),试计算电解池B中生成Fe2+的物质的量。
⑶若循环系统处于稳定工作状态时,电解池A中流入和流出的HI浓度分别为a mol·L-和b mol·L-1,光催化反应生成Fe3+的速率为c mol·L-1,循环系统中溶液的流量为Q(流量为单位时间内流过的溶液体积)。试用含所给字母的代数式表示溶液的流量Q。
41、(2006年北京卷)(14分)铝和氢氧化钾都是重要的工业产品。请回答:
(1)工业冶炼铝的化学方程式是 。
(2)铝与氢氧化钾反应的离子方程式是 。
(3)工业品氢氧化钾的溶液中含有某些含氧酸根杂质,可用离子交换膜法电解提纯。电解槽内装
有阳离子交换膜(只允许阳离子通过),其工作原理如图所示。

①该电解槽的阳极反应式是 。
②通电开始后,阴极附近溶液pH会增大,请简述原因
⑶① 4OH?? 4e? = 2H2O + O2↑② H+放电,促进水的电离,OH?浓度增大③ B
③除去杂质后氢氧化钾溶液从液体出口 (填写“A”或“B”)导出。
40、(2005年全国)(15分)X、Y、Z、W为按原子序数由小到大排列的四种短周期元素。
已知:①X可分别与Y、W形成X2Y,X2Y2、XW等共价化合物;
②Z可分别与Y、W形成Z2Y、Z2Y2、ZW等离子化合物。
请回答:
(1)Z2Y的化学式是 。
(2)Z2Y2与X2Y反应的化学方程式是 。
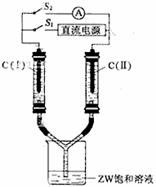 (3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
(3)如图所示装置,两玻璃管中盛满滴有酚酞溶液的ZW饱和溶液,C(Ⅰ)、C(Ⅱ)为多孔石墨电极。
接通S1后,C(Ⅰ)附近溶液变红,两玻璃管中有气体生成。一段时间后(两玻璃管中液面未脱离电极),断开S1,接通S2,电流表的指针发生偏转。此时:
C(I)的电极名称是 (填写正极或负极);
C(II)的电极反应式是 。
(4)铜屑放入稀硫酸不发生反应,若在稀硫酸中加入X2Y2,铜屑可逐渐溶解,该反应的离子方程式是 。
39.(2004全国)在玻璃圆筒中盛有两种无色的互不相溶的中性液体。上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如右图。接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成。停止通电,取出电极,用搅棒上下剧烈搅动。静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色。根据上述实验回答:
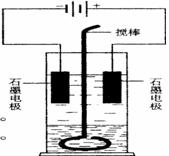 (1)阳极上的电极反应式为_____________________。
(1)阳极上的电极反应式为_____________________。
(2)阴极上的电极反应式为_____________________。
(3)原上层液体是_____________________________。
(4)原下层液体是______________________________。
(5)搅拌后两层液体颜色发生变化的原因是________
(6)要检验上层液体中含有的金属离子,其方法是______________,
现象是_______________________________
_____________。
38.(08海南卷)如何防止铁的锈蚀是工业上研究的重点内容。为研究铁锈蚀的影响因素,某同学做了如下探究实验:
|
序号 |
内容 |
实验现象 |
|
1 |
常温下将铁丝放在干燥空气中一个月 |
干燥的铁丝表面依然光亮 |
|
2 |
常温下将铁丝放在潮湿空气中一小时 |
铁丝表面依然光亮 |
|
3 |
常温下将铁丝放在潮湿的空气中一个月 |
铁丝表面已变得灰暗 |
|
4 |
将潮湿的铁丝放在常温的氧气流中一小时 |
铁丝表面略显灰暗 |
|
5 |
将潮湿的铁丝放在高于常温的氧气流中一小时 |
铁丝表面已变得灰暗 |
|
6 |
将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 |
铁丝表面灰暗程度比实验5严重 |
回答以下问题:
(1)上述实验中发生了电化学腐蚀的是(填实验序号) __________; 在电化学腐 蚀中,负极反应是________________; 正极反应是_______________________;
(2)由该实验可知,可以影响铁锈蚀速率的因素是___________________________; (3)为防止铁的锈蚀,工业上普遍采用的方法是______________(答两种方法)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com