
2. Why is the woman allowed in the theatre with her dog?
A. Her dog is very clever. B. She has got a ticket for it. C. There’re few people there.
Conversation 2
1. Where does this conversation take place?
A. In the theatre. B. At the entrance of the theatre. C. At the box office of the theatre.
19.(12分)本题包括A、B两小题,分别对应于“物质结构与性质”和“实验化学”两个选修模块的内容。请选择其中一题,并在相应的答题区域内作答。若两题都做,则按A题评分。
A(12分)A、B、C、D、E、F是元素周期表中前四周期的六种元素,且原子序数依次增大。已知A元素基态原子的核外电子分占四个原子轨道;B元素基态原子的成对电子数是未成对电子数的3倍;C与B处于同一主族;D是同周期元素中原子半径最小的元素;E元素基态原子的L能层与M能层电子数相等,且等于s能级电子总数;F元素的二价阳离子可与NH3通过配位键形成深蓝色的配离子。
试回答:
(1)A、B、C三种元素,电负性大到小的排列顺序为________________(用元素符号表示)
 (2)价层电子数相同、原子总数相同的分子和离子也属于等电子体,由A-F六种元素形成的微粒中,与CB42-互为等电子体的分子是________(填分子式),CB42-的中心原子的杂化方式为_________
(2)价层电子数相同、原子总数相同的分子和离子也属于等电子体,由A-F六种元素形成的微粒中,与CB42-互为等电子体的分子是________(填分子式),CB42-的中心原子的杂化方式为_________
(3)已知ABD2分子中成键原子均可形成8电子稳定结构,该分子中σ键和п键的数目分别为____________
(4)F元素基态原子的价层电子排布为________________
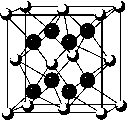
(5)E与最活泼的非金属形成的化合物晶胞结构如右图所示,其中“ ”代表的微粒是_________(用元素符号或离子符号表示)。
”代表的微粒是_________(用元素符号或离子符号表示)。
B(12分)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。
 (1)右图1为实验室制取乙酸乙酯的装置图,
(1)右图1为实验室制取乙酸乙酯的装置图,
①在制取乙酸乙酯时,为提高原料乙酸的利用率所采取的措施有:a. 增大乙醇的浓度 b. 使用浓硫酸作催化剂和吸水剂 c. 。
②实验中,装置B溶液上方收集到一层油状液体,但振荡后油状液体明显减少,振荡导致油状液体减少的原因是________
____________________________________
图1
(2)苯甲酸、甲醇、苯甲酸甲酯的相关物理性质如下:
|
物质 |
室温下色、态 |
密度(g/mL) |
熔点(℃) |
沸点(℃) |
|
苯甲酸 |
白色固体 |
1.2659 |
122 |
249 |
|
甲醇 |
无色液体 |
0.7915 |
-97.8 |
64.65 |
|
苯甲酸甲酯 |
无色液体 |
1.0888 |
-12.3 |
199.6 |
①有同学利用图1装置制备苯甲酸甲酯,结果B装置没有收集到油状液体,实验失败的主要原因是_______________________________________________________
②实验室制取苯甲酸甲酯的流程如图2所示
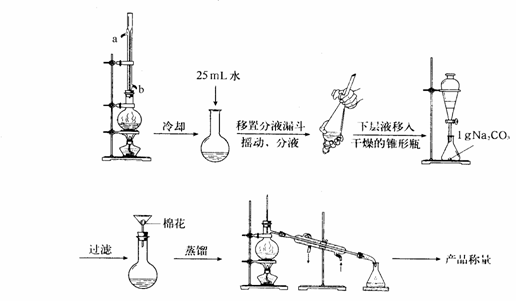
图2
反应装置中冷凝管的进水口为_________,反应后的混合液经冷却与25 mL水混合的目是______________________________,实验中Na2CO3固体的作用是____________________。


18.(10分)工业上用CO生产燃料甲醇。一定条件下发生反应:CO(g)+2H2(g)
CH3OH(g)。图1表示反应进行过程中能量的变化(曲线a未使用催化剂,曲线b使用催化
剂),图2表示一定温度下,在体积为2L的密闭容器中加入4mol H2和一定量的CO后,
CO和CH3OH(g)的浓度随时间变化情况。
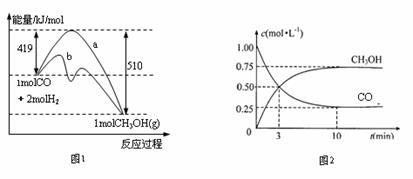
(1)下列说法正确的是
a.使用催化剂时,CO(g)+2H2(g)  CH3OH(g)
CH3OH(g) △H =-91kJ·mol-1
△H =-91kJ·mol-1
b.起始充入的CO为2mol
c.容器中压强保持恒定,表明反应已到达平衡状态
d.保持温度和密闭容器容积不变,再充入1molCO和2molH2,可使平衡时n(CH3OH)/n(CO)
增大
(2)从反应开始到建成平衡, v(H2)=________;该温度下CO(g)+2H2(g)  CH3OH(g)的平衡常数为_______________ 。
CH3OH(g)的平衡常数为_______________ 。
17.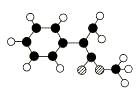 (14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(14分)A是生产某新型工程塑料的基础原料之一,由C、H、O三种元素组成,其分子结构模型如图所示(图中球与球之间连线代表化学键单键或双键)。
(1)根据分子结构模型写出A的分子式____________ ,A分子中至少有________个碳原子一定共平面,A的核磁共振氢谱有_______个吸收峰。
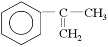 (2)以为主要原理合成A的路线如下:
(2)以为主要原理合成A的路线如下:
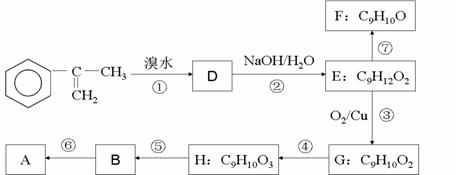
(a)A的合成路线中属于氧化反应的有__________ (填序号)
(b)H的结构简式为___________
(c)写出反应⑥的化学方程式(注明必要的条件)
________________________________________________________
(d)已知反应⑦为消去反应,有同学试图用酸性KMnO4溶液将F直接氧化成B,你认为该想法能否实现?若能,写出反应的化学方程式,若不能请说明原因。
__________________________________________________________________________
(e)G的某同分异构体,苯环上只有一个侧链,且能发生银镜反应和水解反应,写出其可能的结构简式_____________________________________________________
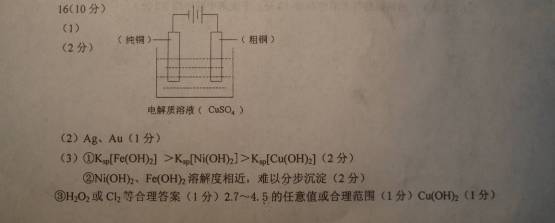
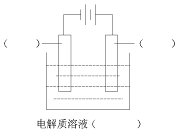
16.(10分)高纯铜(Cu%=99.99%)广泛应用于电器工业,某粗铜样品中含Fe、Ni、Ag、Au等杂质,用电解法进行精炼。
(1)+2+请在下列电解装置图中标明电极材料和电解质溶液
(2)Ni的金属活动性顺序介于Fe和Sn之间,精炼完成后,在阳极底部的沉积物中可回收到__________。
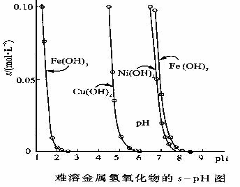
(3)电解完毕后,某兴趣小组欲对电解液中的离子进行分离,他们通过查阅资料,得知相关氢氧化物在不同pH下的溶解度曲线(如右图)。
①结合右图分析,相同温度下Ksp[Cu(OH)2]、Ksp[Ni(OH)2]、Ksp[Fe(OH)2]由大到小的顺序为__________________________
②甲同学试图直接调节溶液pH,分别生成Cu(OH)2、Ni(OH)2、Fe(OH)2沉淀,简要说明该设想是否可行?
____________________________________________________________________________
③乙同学设计了以下操作步骤,顺利完成了溶液中的三种金属元素的分离。
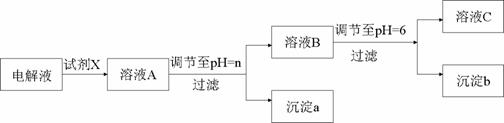
该方案中试剂X为_________,n=__________,沉淀b的化学式为______________。
15.(10分)钼是一种难熔稀有金属,钼及其合金在冶金、农业、电气、化工、环保等重要部门有着广泛的应用。我国钼矿资源十分丰富,由辉钼矿(MoS2)冶炼钼主要包含焙烧和还原两个环节。
(1)下图中左图是辉钼矿多层焙烧示意图,其中1,2,3…是炉层编号,580、630、610…是各炉层的温度(℃);右图给出了各炉层的固态物料组成。例如,图中示出6号炉层上MoO3、MoO2和MoS2的物质的量分数约为20%、60%、20%(总计100%)。
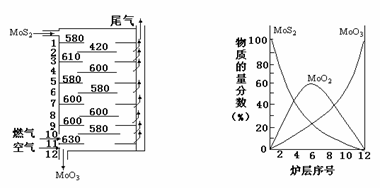
①辉钼矿焙烧时产生尾气,下列有关该尾气的表述正确的有___________
a.能使酸性高锰酸钾溶液褪色
b.用于漂白银耳等食品
c.经净化处理后用于制硫酸
d.增高焙烧炉的烟囱将其热排放到高空
e.通过热交换利用尾气中的热能
②由曲线可知,中层MoO2 增多,MoO3增加并不多,而MoS2减少量很大。试写出MoS2中层焙烧过程中发生的两个反应是2MoS2+7O2=2MoO3+4SO2;______________________
③已知:MoS2(s)+7/2O2(g)=MoO3(s)+2SO2(g) △H1 =-1011 kJ·mol-1
MoO2(s)+1/2O2(g)=MoO3(g) △H2 =-154 kJ·mol-1
用热化学方程式说明中层炉温下降的原因:________________________________________
(2)钼的熔点2620℃,工业上可通过铝热反应将MoO3还原为Mo,反应的化学方程式为________________________________________
14.(10分)Na3AlF6不溶于水,可用作胃毒性和触杀性杀虫剂,搪瓷乳白剂、树脂橡胶的耐磨填充剂,并广泛应用于铝的冶炼。工业上生产Na3AlF6的流程如下:
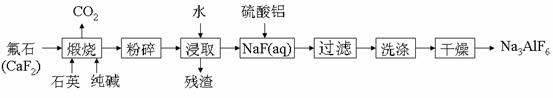
试结合生产流程回答下列问题:
(1)煅烧时总反应的化学方程式为_______________________________________________
(2)煅烧后的固体在浸取前进行粉碎的目的是___________________,为达到相同目的,常温浸取时还可采取的措施是________________________
(3)97.5Kg含CaF280%氟石(杂质不含氟元素)理论上可生产Na3AlF6________Kg(设生产过程中的每一步含氟物质均完全转化)
(4)在按化学计量加入硫酸铝溶液前,需先用_________将NaF(aq)的pH值下调至5左右,否则可能产生的副产物为_________________
(5)在铝的冶炼中,Na3AlF6是一种助熔剂,能使Al2O3在1000℃左右熔融,并可增强体系的导电性。下列有关Na3AlF6性质的叙述不正确的是_______
a.Na3AlF6 在水中不存在沉淀溶解平衡
b.Na3AlF6是离子化合物
c.Na3AlF6热稳定性强
d.Na3AlF6是一种非电解质
13.(12分)某教材为了证明化学反应有一定的限度,安排了下列探究活动:
(Ⅰ)取5mL0.1 mol·L-1的KI溶液,滴加0.1 mol·L-1的FeCl3溶液5-6滴
(Ⅱ)继续加2mLCCl4振荡
(Ⅲ)取萃取后的上层清液,滴加KSCN溶液
(1)探究活动(Ⅰ)和(Ⅱ)的实验现象分别为_________________________________、
____________________________________________
(2)在探究活动(Ⅲ)中,活动设计者的意图是通过生成血红色的Fe(SCN)3,验证有Fe3+残留,从而证明化学反应有一定的限度,但在实验中,却未见溶液呈血红色,对此同学们提出了下列三种猜想。
猜想一:Fe3+已全部转化为Fe2+
猜想二:残留Fe3+浓度极小,未能形成Fe(SCN)3=(SCN)/L
猜想三:生成Fe(SCN)3浓度极小,其颜色肉眼无法观察
为验证猜想,课后同学们查阅了大量资料,获得下列信息:
信息一:乙醚微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大
信息二:Fe3+可与[Fe(CN)6]4-反应生成蓝色沉淀,用K4[Fe(CN)6]溶液检验Fe3+灵敏度比用KSCN更高
同学们结合新信息,设计了以下实验验证其猜想
①请将相关的实验操作、现象和结论填入下表
|
实验操作 |
现象 |
结论 |
|
步骤一:
|
产生蓝色沉淀 |
|
|
步骤二: |
|
“猜想三”成立 |
②写出操作“步骤一”中发生反应的离子方程式___________________________________
③由上述二步实验可推知“猜想二”不能成立,得出该结论的依据是_____________
_____________________________________________________。
12.硝酸工业尾气中的NOx可用纯碱溶液吸收,有关化学反应为①2NO2+Na2CO3=NaNO2 +NaNO3+CO2;②NO+NO2+Na2CO3=2NaNO2 +CO2,现用0.5L 2 mol·L-1的纯碱溶液恰好吸收一定量硝酸工业尾气中的NOx,将生成的CO2全部排出,测得溶液质量增加44g。下列说法不正确的是
A.反应②为非氧化还原反应 B.NO2既有氧化性又有还原性
C.NO2和NO的体积比为5:1 D.NO吸收过程中,共转移1 mole-
II卷(非选择题,共78分)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com