
14、已知酸式盐NaHB在水溶液中,HB-的电离程度小于HB-的水解程度,下列说法正确的是 ( )
A.HB-水解方程式:HB-+H2O H3O+
+B2-
H3O+
+B2-
B.溶液中离子浓度大小为:c(Na+)>c(HB-)>c(OH-) >c(H+)
C.NaHB的存在抑制了水的电离
D.相同物质的量浓度溶液的pH值:NaHB > Na2B
13、某温度下重水中存在如下电离平衡:D2O D++OD-,重水的kW=1.0×10-12,若pD=-lg{c(D+)},则该温度下有关分析正确的是
( )
D++OD-,重水的kW=1.0×10-12,若pD=-lg{c(D+)},则该温度下有关分析正确的是
( )
A.0.1 mol NaOD溶于重水形成1 L溶液,其pD=13
B.将pD=4的DCl的重水溶液,用重水稀释100倍,其pD=6
C.向30 mL 0.5 mol·L-1 NaOD的重水溶液加入20 mL 0.5 mol·L-1 DCl的重水溶液,所得溶液的pD=13
D.pD=10的NaOD重水溶液中,由重水电离出的c(OD-)约为1×10-10 mol·L-1
12、有pH值相等的A、B、C、D四种一元酸的溶液各20 mL,与过量镁充分反应后,产生氢气质量是D>C>B=A。这说明:①D的酸性最强。②A与B的酸性最强且彼此相当。③原D溶液能中和氢氧化钠的物质的量最大。④反应后原A和B的溶液的pH值最大;⑤反应前D的电离程度最大,⑥反应前四种酸的电离程度相同,其中正确的是 ( )
A.①③⑤ B.②④⑥ C.①⑥ D.②③
11、如下图所示的两个实验装置中,溶液的体积均为200 mL,开始时电解质溶液的浓度均为0.1 mol·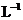 ,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑盐的水
,工作一段时间后,测得导线中均通过0.02 mol电子,若不考虑盐的水
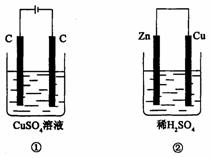 解和溶液体积的变化,下列叙述中正确
( )
解和溶液体积的变化,下列叙述中正确
( )
A.产生气体的体积:①>②
B.电极上析出物质的质量:①>②
C.溶液的pH变化:①增大,②减小
D.电极反应式
①中阳极: 4OH--4e-=2H2O+O2↑ ②中负极:2H++2e-=H2↑
10、若1体积Ba(OH)2溶液恰好与10体积pH=4的醋酸完全反应,则二者物质的量浓度之比为 ( )
A.1:5 B.5:1 C.10:1 D.无法确定
9、25℃时pH=6的HCl和NH4Cl溶液,其中水电离出的c(H+)分别为xmol·L-1、ymol·L-1。两者关系为 ( )
A.相等 B.x>y C.x=10-2y D.x=102y
8、用已知物质的量浓度的盐酸滴定未知物质的量浓度的NaOH溶液(酚酞作指示剂)。下列情况使结果偏高的是 ( )
①酸式滴定管用水洗后直接装液体进行滴定;②碱式滴定管水洗后,就用来量取待测液;③锥形瓶用蒸馏水洗涤后,又用待测液润洗;④将碱液溅到锥形瓶壁而又未摇匀洗下;⑤盐酸在滴定时溅出锥形瓶外;⑥配制待测溶液时称取的NaOH固体中含有NaHCO3杂质;⑦滴定前,酸式滴定管有气泡,滴定后消失;⑧记录标准液起始体积时,仰视读数,终点时俯视。
A.①③⑤⑦ B.②④⑥⑧ C.①③⑥⑧ D.①②③⑤
7、常温下,将0.1 mol下列物质置于0.5 L水中充分搅拌后,溶液中阴离子数目从大到小的排列顺序正确的是 ( )
①Na2O2 ②Na2S ③NaAlO2 ④AlC13
A.④①②③ B.②①③④ C.④①③② D.④②①③
6、原电池的电极不仅名称与电极材料的性质有关,也与电解质溶液有关。下列说法中不正确的是 ( )
A.由Al、Cu、稀H2SO4组成原电池,负极反应式为:Al-3e-=Al3+
B.由Mg、Al、NaOH溶液组成原电池,负极反应式为:Al-3e-+4OH-=AlO2-+2H2O
C.由Fe、Cu、FeCl3溶液组成原电池,负极反应式为:Cu-2e-=Cu2+
D.由Al、Cu、浓硝酸组成原电池,负极反应式为:Cu-2e-=Cu2+
5、对于相同体积的碳酸钾溶液(浓度为c1)和碳酸铵溶液(浓度为c2),若其中CO32-的物质的量浓度相同,则c1和c2的关系正确的是 ( )
A.c1=2c2 B.c1 > c2 C.c1=c2 D.c1 < c2
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com