
31.(16分)紫杉醇是从红豆杉属植物中提取的最有效的抗癌制剂之一。目前,生产紫杉醇的主要原料是天然生长的红豆杉树皮,而大量剥取树皮会造成树木的死亡和资源的破坏。请回答下列问题。
(1)为了合理开发和利用红豆杉,保护野生植物资源,科研人员取生长状况相似的野生南方红豆杉和人工栽培的南方红豆杉,分别测量其不同部位完全烘干的样品中紫杉醇的含量(占千重的百分比),测定结果见表1。
表1 南方红豆杉树木各部位紫杉醇含量(%,w/w)
|
|
树皮 |
树叶 |
枝条 |
种子 |
|
野生植株 |
0.01777 |
0.00946 |
0.01280 |
0.01406 |
|
人工栽培植株 |
0.01483 |
0.00102 |
0.00193 |
0.01256 |
从实验结果看,红豆杉中紫杉醇含量最高的部位是 ,不同部位紫杉醇含量不同的根本原因是 。为保护红豆杉资源,应以其 为原料,提取、分离紫杉醇。
(2)科研人员为寻找更多紫杉醇来源,尝试利用植物组织培养技术,从红豆杉的愈伤组织中提取紫杉醇。实验结果如表2所示。
表2 不同外植体形成的愈伤组织中紫杉醇含量(%,w/w)
|
实验 组别 |
培养基中植物生长调节剂的组合与水平 |
外植体 |
||
|
树皮 |
树叶 |
顶端分生组织 |
||
|
1 |
2mg/L2,4 – D |
0.000 |
0.000 |
0.001 |
|
2 |
2mg/L2,4 – D+0.5mg/L NAA |
0.000 |
0.002 |
0.002 |
|
3 |
2mg/L2,4 – D+0.5mg/L KT |
0.004 |
0.027 |
0.004 |
|
4 |
1.5mg/L2,4 – D+0.5mg/L KT |
0.000 |
0.012 |
0.009 |
|
5 |
0.5mg/L2,4 – D+1mg/L NAA+0.5MG/L KT |
0.000 |
0.027 |
0.004 |
①该实验的目的是研究 。
②上述实验结果说明 最适合做外植体,经过 过程形成愈伤组织。
(3)2,4-D作为植物生长调节剂,在生产实践中还可以应用在 等方面(写出两点即可)。
30.(16分)体色是划分鲤鱼品种和检验其纯度的一个重要指标。不同鲤鱼品种的体色不同,是由于鱼体鳞片和皮肤含有不同的色素细胞及其数量分布差异所致。科研人员用黑色鲤鱼(简称黑鲤)和红色鲤鱼(简称红鲤)杂交,F1皆表现为黑鲤,F1自交结果如下表所示,请回答下列问题。
|
取样地点 |
取样总数 |
F2性状分离情况 |
||
|
黑鲤 |
红鲤 |
黑鲤:红鲤 |
||
|
1号池 |
1699 |
1592 |
107 |
14.88:1 |
|
2号池 |
62 |
58 |
4 |
14.50:1 |
(1)鲤鱼体色中的 是显性性状。
(2)分析实验结果推测:鲤鱼的体色是由 对基因控制的,该性状的遗传遵循
定律。
(3)为验证上述推测是否正确,科研人员又做了如下实验:
①选择纯合黑鲤鱼是纯合红鲤做亲本杂交获得F1;
②
③
预期结果 。
(4)如果 与 相符,说明上述推测成立。
29.(18分)下图表示在无机环境和生物体内碳元素的转移途径。请据图回答下列问题。
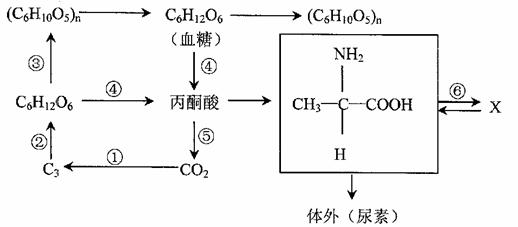
(1)①过程发生的部位是 ,完成该过程需要 。
(2)完成②过程需要 反应提供的 。
(3)植物体内通过③过程合成的有机物(C6H10O5)n包括 。
(4)过程④、⑤共同的产物是 。
(5)若X是抗体,产生此物质的细胞是 ,该细胞中完成⑥过程的场所是 。
(6)土壤中能产生脲酶的微生物可以分解尿素。因此,可以利用 的选择培养基培养分离出尿素分解菌。
28.(20分)有机化合物F是合成电子薄膜材料高聚物Z和增塑剂P的重要原料。
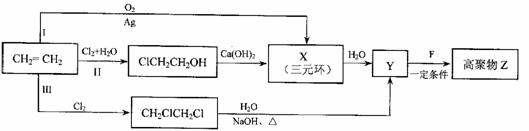 (1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
(1)某同学设计了由乙烯合成高聚物Z的3条路线(I、II、III)如下图所示。
①3条合成路线中,你认为符合“原子经济”要求的合成路线是(填序号“I”、“II”或“III”) 。
②X的结构简式是 。
③1molF在O2中充分燃烧,生成CO2和H2O的物质的量之比为8:3,消耗7.5molO2,其核磁共振氢谱中的3个吸收峰,且能与NaHCO3反应生成CO2。F分子中含有的含氧官能团的名称是 。
Y+F→Z反应的化学方程式是 。
(2)已知: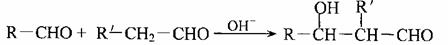
(R、R′代表烃基或氢原子)
合成P的路线如下图所示。D分子中有8个碳原子,其主链上有6个碳原子,且分子内只含有两个-CH3。
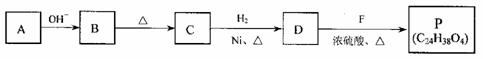
①A→B反应的化学方程式是 。
②B→C的反应中,B分子在加热条件下脱去一个水分子,生成C;C分子中只有1个碳原子上无氢原子。C的结构简式是 。
③P的结构简式是 。
④符合下列条件的B的同分异构体共有(填数字) 种。
a. 在酸性条件下水解为M和N b. 一定条件下M可以转化为N
⑤已知:RCH=CHCHO+H2  RCH=CHCH2OH
RCH=CHCH2OH
(R代表烃基或氢原子)
A的同系物W的相对分子质量为44。请参照示例写出以W和另一种有机物为原料合成肉桂醇(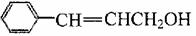 )的合成路线:
。
)的合成路线:
。
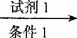
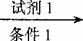
(示例:反应物 产物 产物2……)
27.(14分)甲、乙、丙、丁是由短周期元素组成的物质,它们之间存在如下转化关系。
甲+乙→丙+丁
(1)转化关系中所涉及的反应为非氧化还原反应,且乙为水。
①若甲为块状固体,丙为可燃性气体,其分子内既含有极性键又含有非极性键。则丙的电子式是 。
 ②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。
②若甲是由N和Cl元素组成的化合物,其分子结构模型如右图所示,丙具有漂白性。则甲中Cl元素的化合价是 。
(2)转化关系中所涉及的反应为氧化还原反应,且乙为水。
①若甲和丙是同主族元素组成的单质,且组成甲的元素
位于第三周期,此反应的离子方程式是 。
②若丙和丁都可在一定条件下还原CuO,此反应的化学方程式是 。
 ③若甲是由N和O元素且成的气态物质,呈红棕色。将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程式是
。
③若甲是由N和O元素且成的气态物质,呈红棕色。将3.36g Fe加到一定量丙溶液中,收集到1.12L气体丁(已折算为标准状况),则反应的离子方程式是
。
(3)Hofmann依据上述转化关系测定氨分子的组
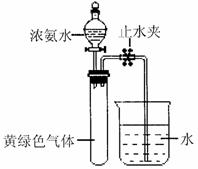
成。现用如右图所示的装置进行实验,打止
分液漏斗的活塞,滴下浓氨水,至不再反应
为止;关闭分液漏斗的活塞,待恢复到室温,
打开止水夹,试管内液面上升至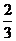 处。
处。
①滴下浓氨水一段时间后,试管内发生反应的
化学方程式是 。
②证明试管内“不再反应”的实验操作和现象是 。
26.(10分)
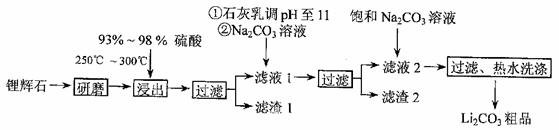
工业上以锂辉石(Li2O·Al2O3·4SiO2,含少量Ca、Mg元素)为原料生产碳酸锂。其部分工艺流程如下:
已知:①Li2O·Al2O3·4SiO2+H2SO4(浓)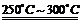 Li2SO4+Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示。
Li2SO4+Al2O3·4SiO2·H2O↓②某些物质的溶解度(S)如下表所示。
|
T/℃ |
20 |
40 |
60 |
80 |
|
S(Li2CO3)/g |
1.33 |
1.17 |
1.01 |
0.85 |
|
S(Li2CO3)/g |
34.2 |
32.8 |
31.9 |
30.7 |
(1)从滤渣I中分离出Al2O3部分的流程如下图所示,括号表示加入的试剂,方框表示所得到的物质。则步骤II中反应的离子方程式是 。
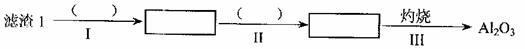
(2)已知滤渣2的主要成分有Mg(OH)2和CaCO3。
向滤液1中加入石灰乳的作用是(运用化学平衡原理简述) 。
(3)向滤液2中加入饱和Na2CO3溶液,过滤后,用“热水洗涤”的原因是 。
(4)工业上,将Li2CO3粗品制备成高纯Li2CO3的部分工艺如下。
a. 将Li2CO3溶于盐酸作电解槽的阳液,LiOH溶液作阴极液,两者用离子选择透过膜隔开,用惰性电极电解。
b. 电解后向LiOH溶液中加入过量NH4HCO3溶液,过滤、烘干得高纯Li2CO3。
①a中,阳极的电极反应式是 。
②b中,生成Li2CO3反应的化学方程式是 。
25.(14分)过氧化氢对环境友好,性质多样,有很重要的研究和应用价值。
(1)实验室利用反应2H2O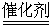 2H2O+O2↑可制备氧气。
2H2O+O2↑可制备氧气。
①取等物质的量浓度等体积H2O2溶液分别进行下列实验,研究外界条件对该反应速率的影响,实验报告如下表所示。
|
序号 |
条件 |
现象 |
结论 |
|||
|
温度/℃ |
催化剂 |
|||||
|
1 |
40 |
FeCl3溶液 |
|
|
||
|
2 |
20 |
FeCl3溶液 |
|
|
||
|
3 |
20 |
MnO2 |
|
|
||
|
4 |
20 |
无 |
|
|
实验1、2研究的是 对H2O2分解速率的影响。
实验2、3的目的是 。
实验中可以表明该反应速率差异的现象是 。
②实验室用MnO2做该反应的催化剂,使用如右图所示
装置的A部分制备O2,避免反应过于剧烈的操作是
。
(2)Na2O2与水反应也可生成O2。某同学取4g Na2O2样品与过量水反应,待反应完全终止时,得100mL溶液X和448mLO2(已折算为标准状况)。该同学推测样品中含有杂质或反应中生成H2O2,并进行实验研究。
①取少量X于试管中,滴加FeCl2溶液,立即生成红褐色沉淀。则反应了离子方程式是 。
②通过如下图所示整套实验装置测定Na2O2样品的纯度,假设所含杂质不参加反应。取25mLX,滴入烧瓶内使其与过量KMnO4酸性溶液反应,最终生成56mLO2(已折算为标准状况),则此样品中Na2O2的质量分数是 。
24.(20分)
在如图所示的x – o – y 坐标系中,y>0的区域内存在着沿y轴正方向、场强为E的匀强电场,y<0的区域内存在着垂直纸面向里、磁感应强度为B的匀强磁场。一带电粒子从y轴上的P(0,h)点以沿x轴正方向的初速度射出,恰好能通过x轴上的D(d,0)点。已知带电粒子的质量为m,带电量为-q。h、d、q均大于0。不计重力的影响。
(1)若粒子只在电场作用下直接到达D点,求粒子初速度的大小v0;
(2)若粒子在第二次经过x轴时到达D点,求粒子初速度的大小v0;
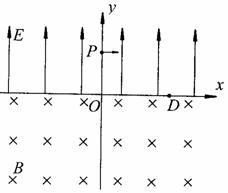 (3)若粒子在从电场进入磁场时到达D点,求粒子初速度的大小v0;
(3)若粒子在从电场进入磁场时到达D点,求粒子初速度的大小v0;
23.(18分)
1897年汤姆逊发现电子后,许多科学家为测量电子的电荷量做了大量的探索。1907-1916年密立根用带电油滴进行实验,发现测滴所带的电荷量是某一数值e的整数倍,于是称这一数值e为基本电荷。
如图所示,完全相同的两块金属板正对着水平放置,板间距离为d。当质量为m的微小带电油滴在两板间运动时,所受空气阻力的大小与速度大小成正比。两板间不加电压时,可以观察到油滴竖直向下做匀速运动,通过某一段距离所用时间为t1;当两板间加电压U(上极板的电势高)时,可以观察到同一油滴竖直向上做匀速运动,且在时间t2内运动的距离与在时间t1内运动的距离相等。忽略空气浮力。重力速度为g。
(1)判断上述油滴的电性,要求说明理由;
(2)求上述油滴所带的电荷量Q;
(3)在极板间照射X射线可以改变油滴的带电量。再采用上述方法测量油滴的电荷量。如此重复操作,测量出油滴的电荷量Qi如下表所示。如果存在基本电荷,请根据现有数据求出基本电荷的电荷量e(保留到小数点后两位)。
|
实验次序 |
1 |
2 |
3 |
4 |
5 |
|
电荷量 Qi(10-18C) |
0.95 |
1.10 |
1.41 |
1.57 |
2.02 |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com