
综上所述:液滴能射出,
K应满足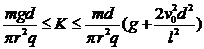 1分
1分
(2)B=B0+Kt
当液滴从两板中点射出进,满足条件一的情况,则
用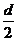 替代⑧式中的d
替代⑧式中的d 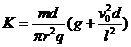 2分
2分
即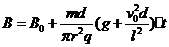 2分
2分
高频考点五十八 导电滑轨问题
263.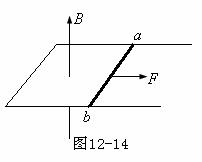 海南省海口市2010届高三调研测试如图12-14所示:宽度L=1m的足够长的U形金属框架水平放置,框架处在竖直向上的匀强磁场中,磁感应强度B=1T,框架导轨上放一根质量m=0.2kg、电阻R=1.0Ω的金属棒ab,棒ab与导轨间的动摩擦因数μ=0.5,现用功率恒为6w的牵引力F使棒从静止开始沿导轨运动(ab棒始终与导轨接触良好且垂直),当棒的电阻R产生热量Q=5.8J时获得稳定速度,此过程中,通过棒的电量q=2.8C(框架电阻不计,g取10m/s2)。问:
海南省海口市2010届高三调研测试如图12-14所示:宽度L=1m的足够长的U形金属框架水平放置,框架处在竖直向上的匀强磁场中,磁感应强度B=1T,框架导轨上放一根质量m=0.2kg、电阻R=1.0Ω的金属棒ab,棒ab与导轨间的动摩擦因数μ=0.5,现用功率恒为6w的牵引力F使棒从静止开始沿导轨运动(ab棒始终与导轨接触良好且垂直),当棒的电阻R产生热量Q=5.8J时获得稳定速度,此过程中,通过棒的电量q=2.8C(框架电阻不计,g取10m/s2)。问:
(1)ab棒达到的稳定速度多大?
(2)ab棒从静止到稳定速度的时间多少?
解:(1) 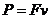 … ① (1分)
… ① (1分)
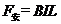 … ②
(1分)
… ②
(1分)
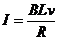 … ③
(1分)
… ③
(1分)
棒稳定时: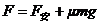 … ④ (1分)
… ④ (1分)
由①②③④联立解得 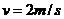 (1分)
(1分)
(2)由能量守恒得: ①
(2分)
①
(2分)
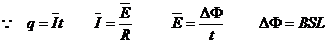
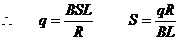 ② (2分)
② (2分)
(直接写出 得出② 式亦可得分)
得出② 式亦可得分)
由① ②联立解得: 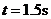 (2分)
(2分)
液滴不发生偏转,做匀速直线运动,此时 a=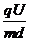 -g=0 1分
-g=0 1分
由②③⑨得 K2=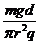 1分
1分
液滴能射出,必须满足K=K2
22.(14分)某研究性学习小组用HNO3与大理石反应过程中质量减小的方法,探究影响反应速率的因素。所用HNO3浓度为1.00 mol·L-1、2.00 mol·L-1,大理石有细颗粒与粗颗粒两种规格,实验温度为298 K、308 K,每次实验HNO3的用量为25.0 mL、大理石用量为10.00 g。
(1)请完成以下实验设计表,并在实验目的一栏中填出对应的实验编号:
|
实验编号 |
T/K |
大理石规格 |
HNO3浓度/mol·L-1 |
实验目的 |
|
① |
298 |
粗颗粒 |
2.00 |
(Ⅰ)实验①和②探究HNO3浓度对该反应速率的影响; (Ⅱ)实验①和 探究温度对该反应速率的影响; (Ⅲ)实验①和 探究大理石规格(粗、细)对该反应速率的影响。 |
|
② |
|
|
|
|
|
③ |
|
|
|
|
|
④ |
|
|
|
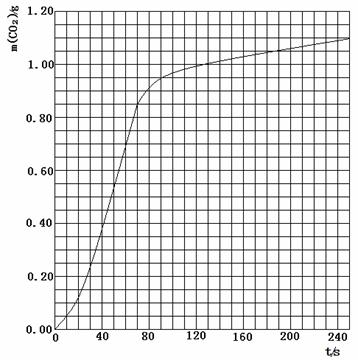
(2)实验①中CO2质量随时间变化的关系见下图:
依据反应方程式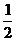 CaCO3+HNO3=
CaCO3+HNO3=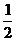 Ca(NO3)2+
Ca(NO3)2+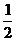 CO2↑+
CO2↑+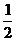 H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
H2O,计算实验①在70-90 s范围内HNO3的平均反应速率(忽略溶液体积变化,写出计算过程)。
信阳市2009-2010学年度下期第一学段高中一年级模块检测
21.(6分)已知化学能与其他形式的能可以相互转化。填写下表的空白:
|
化学反应方程式(例子) |
能量转化形式 |
|
① |
由化学能转化为热能 |
②Pb+PbO2+2H2SO4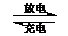 2PbSO4+2H2O 2PbSO4+2H2O |
|
③CaCO3 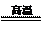 CaO+CO2↑ CaO+CO2↑ |
|
20.(7分)如图为原电池装置示意图:
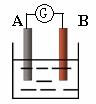
(1)若A为Zn,B为石墨棒,电解质溶液为稀硫酸,则A电极名称为 ,写出正极的电极反应式 。
(2)若A为铜片,B为铁片,电解质为FeCl3溶液,则作铜片为 极(填正或负),写出电极反应式:正极 ,负极 。
(3)若A、B均为铂片,电解质为KOH溶液,分别从A、B两极通入H2和O2,该电池即为燃料电池,通入氧气的一极为该电池的 极(填正或负),该电池的总反应为: 。
19.(7分)如右图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题:
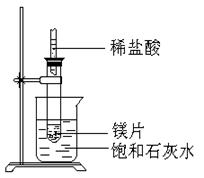
(1)实验中观察到的现象是
。
(2)产生该现象的原因 。
(3)写出有关反应的离子反应方程式 。
(4)有此推知,MgCl2溶液和H2的总能量 填(“大于”“小于”或“等于”)镁片和盐酸的总能量。
18.(6分)A、B、C、D、E、F、G都是由短周期元素构成的粒子,它们都有10个电子,结构特点如下表:
|
粒子代号 |
A |
B |
C |
D |
E |
F |
G |
|
原子核个数 |
单核 |
单核 |
双核 |
四核 |
单核 |
五核 |
五核 |
|
电荷数 |
0 |
1+ |
1- |
0 |
2+ |
1+ |
0 |
请填写下列空白:
(1)A粒子的结构示意图为 、D粒子的电子式为 、G粒子的化学式为 ;
(2)BC和EC2的碱性强弱为BC EC2(填:>、<或=);
(3)加热条件下,F与C在溶液中反应的离子方程式为 。
17.(12分)下表是元素周期表的一部分,回答下列有关问题(用化学符号回答):
 族 族周期 |
ⅠA |
ⅡA |
ⅢA |
ⅣA |
ⅤA |
ⅥA |
ⅦA |
0 |
|
2 |
|
|
|
|
① |
② |
③ |
|
|
3 |
④ |
⑤ |
⑥ |
⑦ |
|
|
⑧ |
⑨ |
|
4 |
⑩ |
|
|
|
|
|
|
|
(1)在①-⑩元素中,最活泼的金属元素是 ,最活泼的非金属元素是 ,最不活泼的元素是 。
(2)在①-⑩元素的最高价氧化物对应的水化物中,酸性最强的是 ,碱性最强的是 ,呈两性的是 。写出在水溶液中三者之间相互反应的离子方程式: , ,
。
16.C、CH4、CO、C2H5OH是常用的燃料,它们每1 mol 分别完全燃烧生成CO2(g)及H2O(l)时,放出的热量依次为393.5kJ、890.3kJ、110.5kJ、1366.8kJ。相同质量的这4种燃料,完全燃烧时放出热量最多的是( )
A. C B. CH4 C.CO D. C2H5OH
信阳市2009-2010学年度下期第一学段高中一年级模块检测
化 学 试 卷
第Ⅰ卷选择题答题栏(每小题3分,共48分)
第Ⅱ卷(非选择题,共52分)
15.100 mL 6 mol·L-1 H2SO4 跟足量锌粉反应,在一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
A.碳酸钠固体 B.硝酸钠 C.硫酸钾固体 D.醋酸钠固体
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com