
9.下列反应属于氧化还原反应的是( ) A.漂白粉吸收空气中的二氧化碳 B.用萤石和浓硫酸制取氟化氢 C.氯水使有色布条褪色 D.黑白照片的底片在相机里曝光时的反应
8. 液氯和氨的反应同氯气与水的反应类似,则氯气通入液氨中,产物可能有( )
A.  B.
B.  C.
C.  D.
D. 
7.已知Cl2与Br-、I-可发生反应:Cl2+2I-=I2+2Cl-、Cl2+2Br-=Br2+2Cl-,且Br-、I-的还原性强弱顺序为:
I->Br-。某溶液中Cl-、Br-、I-的物质的量依次为0.2mol、0.4mol、0.6mol,欲使其Cl-、Br-、I-的物质的量比为1︰1︰1,需通入Cl2,那么通入Cl2的物质的量是原溶液中I-物质的量的( )
A.1/2 B.1/3 C.2/3 D.1/6
6.下列离子方程式正确的是( )
A.氯气与水反应:Cl2+H2O=2H++Cl-+ClO-
B.氯气与氢氧化钠溶液反应:Cl2+2OH-=Cl-+ClO-+H2O
C.向留有残氯(Cl2)的水中加一定量的FeSO4,以除去水中的Cl2:Fe2++Cl2=2Cl-+Fe3+
D.漂白粉溶液中通入少量二氧化碳气体:Ca2++2ClO-+H2O+CO2=CaCO3↓+2HClO
5.F2是氧化性最强的非金属单质,物质的量相等的F2跟烧碱完全反应,生成NaF、H2O和另一种气体,该气体是下列中的( )
A.H2 B. HF C.OF2 D.O2
4.有关卤素的说法正确的是( ) A.卤素是典型的非金属元素其单质只具有氧化性而无还原性. B.卤素单质的熔点随相对分子质量的增大而升高. C.卤化银都不溶于水,也不溶于稀硝酸. D.卤化氢的水溶液都是强酸
3.下列物质加入溴水,经振荡,不因发生化学反应而使溴水褪色的是 ( )
A.Na2S B.NaOH C.甲苯 D.裂化汽油
2.将一盛满Cl2的试管倒立在水槽中,当日光照射一段时间后,试管中最后剩余气体的体积约占试管容积的( )
A.1/4 B.1/2 C.1/3 D.2/3
1.市售“家用消毒液发生器”是以精盐和自来水为原料,通电时,发生器内的电极板上产生大量的气泡(同时使产生的气体充分与电解液接触),所制得的混合液具有强烈的杀菌能力,且不对人体造成伤害。该发生器配制消毒液所涉及到的化学反应有( )
①2NaCl+2H2O==2NaOH+Cl2↑+H2↑ ②Cl2+2NaOH=NaCl+NaClO+H2O
③H2+Cl2=2HCl ④Cl2+H2O=HCl+HClO ⑤2HClO=2HCl+O2↑
A. ①④⑤ B. ①② C. ③④⑤ D. ②③④
3.卤素间的置换反应及X-离子的检验:
(1)Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Br2 + 2I- = I2 + 2Br-
结论:氧化性:Cl2 > Br2 > I2; 还原性:I- > Br- > Cl-
(2)溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化
|
溶剂 溶质 |
水 |
苯 |
汽 油 |
四氯化碳 |
|
Br2 |
黄 → 橙 |
橙 → 橙红 |
橙 → 橙红 |
橙→ 橙红 |
|
I2 |
深黄→ 褐 |
淡紫 → 紫红 |
淡紫→ 紫红 |
紫→ 深紫 |
|
密
度 |
 |
比 水 轻 |
比 水 轻 |
比 水 重 |
(3)X-离子的检验
 Cl-
白色沉淀
Cl-
白色沉淀
 Br- + AgNO3 +
HNO3
浅黄色沉淀
Br- + AgNO3 +
HNO3
浅黄色沉淀
I- 黄色沉淀
|

[例1](2010四川理综卷) (16分)
 碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘被称为“智力元素”,科学合理地补充碘可防止碘缺乏病。
碘酸钾(KIO3)是国家规定的食盐加碘剂,它的晶体为白色,可溶
于水。碘酸钾在酸性介质中与过氧化氢或碘化物作用均生成单质
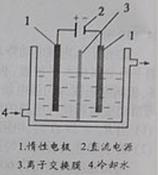
碘。以碘为原料,通过电解制备碘酸钾的实验装置如右图所示。
请回答下列问题:
(1)碘是 (填颜色)固体物质,实验室常用
方法来分离提纯含有少量杂质的固体碘。
(2)电解前,先将一定量的精制碘溶于过量氢氧化钾溶液,溶解时发生反应:
3I2+6KOH=5KI+KIO3+3H2O,将该溶液加入阳极区。另将氢氧化钾溶液加入阴极区,电解槽用水冷却。
电解时,阳极上发生反应的电极反应式为 ;阴极上观察到的实验现象是 。
(3)电解过程中,为确定电解是否完成,需检验电解液中是否有I—。请设计一个检验电解液中是否有I—的实验方案,并按要求填写下表。
要求:所需药品只能从下列试剂中选择,实验仪器及相关用品自选。
试剂:淀粉溶液、碘化钾淀粉试纸、过氧化氢溶液、稀硫酸。
|
实验方法 |
实验现象及结论 |
|
|
|
(4)电解完毕,从电解液中得到碘酸钾晶体的实验过程如下:
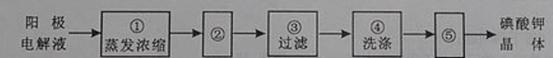
步骤②的操作名称是 ,步骤⑤的操作名称是 。步骤④洗涤晶体的目的是
。
答案:(1)紫黑色 升华
(2)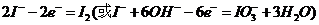
有气泡产生
(3)
|
实验方法 |
实验现象及结论 |
|
取少量阳极区电解液于试管中,加稀硫酸酸化后加入几滴淀粉试液,观察是否变蓝。 |
如果不变蓝,说明无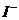 。(如果 。(如果变蓝,说明有 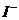 。) 。) |
(4)冷却结晶 干燥 洗去吸附在碘酸钾晶体上的氢氧化钾等杂质
解析:(1)考查物质的物理性质,较容易。(2)阳极发生氧化反应失电子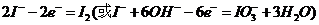 。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验此题借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
。阴极区加入氢氧化钾溶液,电解氢氧化钾实质是电解水。(3)考查I-的检验此题借助与碘单质遇淀粉变蓝色这一特性,要设法将碘离子转化为碘单质。(4)考查实验的基本操作。要求考生对整个流程分析透彻。
[例2](2009天津卷,3)下列实验设计和结论相符的是 ( )
A.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
B.某气体能使湿润的红色石蕊试纸变蓝,该气体水溶液一定显碱性
C.某无色溶液中加Ba(NO3)2溶液,再加入稀盐酸,沉淀不溶解,则原溶液中一定有SO42-
D.在含FeCl2杂质的FeCl3溶液中通足量Cl2后,充分加热,除去过量的Cl2,即可得到较纯净的FeCl3溶液
答案 B
解析 A项,乙醇不可以作为萃取剂,错;
B项,石蕊变蓝,则肯定为碱性,正确。
C项,若原溶液中含有SO32 -,生成BaSO3,再加入HCl,则与溶液的NO3- 结合,相当于HNO3,则可以氧化BaSO3至BaSO4,沉淀不溶解,故错;
D项,加热时,FeCl3会水解,错。
[例3](2009江苏卷14)I2在KI溶液中存在下列平衡:
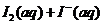

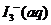
某I2、、KI混合溶液中,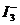 的物质的量浓度c(
的物质的量浓度c(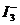 )与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
(
)
)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是
(
)
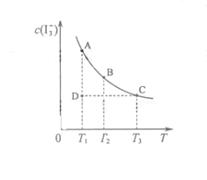
A.
反应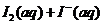

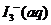 的△H>0
的△H>0
B.若温度为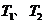 ,反应的平衡常数分别为
,反应的平衡常数分别为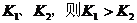
C.若反应进行到状态D时,一定有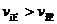
D.状态A与状态B相比,状态A的c(I2)大
答案 BC
解析 随着温度的不断升高,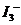 的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以
的浓度逐渐的减小,说明反应向逆方向移动,也就意味着该反应是放热反应,所以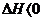 ,所以A项错;
,所以A项错;
因为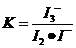 ,
,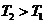 ,所以当温度升高时,反应向逆方向移动,即
,所以当温度升高时,反应向逆方向移动,即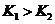 ;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时
;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时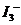 的浓度在增加,所以
的浓度在增加,所以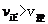 ,C项正确;
,C项正确;
D项,从状态A到状态B,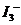 的浓度在减小,那么
的浓度在减小,那么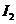 的浓度就在增加。
的浓度就在增加。
卤素单元测试
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com