
2.卤素元素的有关特性:
(1)F2遇水发生置换反应,生成HF并放出O2。
(2)HF是弱酸、剧毒,但能腐蚀玻璃4HF + SiO2 == SiF4↑ + 2H2O;HF由于形成分子
间氢键相互缔合,沸点反常的高。
(3)溴是唯一的液态非金属,易挥发,少量的液溴保存要用水封。
(4)碘易升华,遇淀粉显蓝色;碘的氧化性较弱,它与变价金属反应时生成低价化合物。
(5)AgX中只有AgF溶于水,且不具有感光性;CaF2中只有CaF2难溶。
1.卤素及化合物的性质比较:
|
|
|
氟 |
氯 |
溴 |
碘 |
|
单质物理性质 |
状态 |
气 |
气(易液化) |
液(易挥发) |
固(易升华) |
|
熔、沸点 |
熔、沸点逐渐升高 |
||||
|
颜色 |
淡黄绿色 |
黄绿色 |
红棕色 |
紫黑色 |
|
|
密度 |
密度逐渐增大 |
||||
|
X2与H2化合 |
条件 |
冷暗处 |
光照 |
加热 |
持续加热 |
|
程度 |
剧烈爆炸 |
爆炸 |
缓慢 |
化合同时分解 |
|
|
X2与H2O化合 |
反应 |
2F2+2H2O=4HF+O2 |
X2
+ H2O = HX + HXO |
||
|
程度 |
剧烈 |
缓慢 |
微弱 |
极弱 |
|
|
水溶性 |
|
反应生成氢氟酸 |
水溶性依次减小,有机溶剂中溶解性依次增大 |
||
|
化合价 |
|
只有-1价 |
有-1、+1、+3、+5、+7等 |
||
|
含氧酸 |
化学式 |
无含氧酸 |
有HXO、HXO2、HXO3、HXO4等 |
||
|
强弱程度 |
|
同一价态的酸性依次减弱 |
|||
|
卤化银 |
颜色 |
AgF(白) |
AgCl(白) |
AgBr(淡黄) |
AgI(黄) |
|
水溶性 |
易溶 |
均难溶,且溶解度依次减小 |
|||
|
感光性 |
难分解 |
见光均易分解,且感光性逐渐增强 |
3.氯化氢的实验室制法
(1)药品及反应原理:
 NaCl + H2SO4 === NaHSO4 + HCl↑ (不加热或微热)
NaCl + H2SO4 === NaHSO4 + HCl↑ (不加热或微热)
 NaHSO4 + NaCl Na2SO4 + HCl↑ (加热到500ºC—600ºC)
NaHSO4 + NaCl Na2SO4 + HCl↑ (加热到500ºC—600ºC)
总反应式: 2NaCl + H2SO4 Na2SO4 + 2HCl↑
(2)装置: 与制氯气的装置相似
(3)收集方法: 向上排空气法
(4)检验方法: 用湿润的蓝色石蕊试纸是否变红或用玻璃棒蘸浓氨水靠近是否有白烟产生
(5)尾气处理: 用水吸收(倒扣漏斗)
|

[例1](2010上海卷)右图是模拟氯碱工业生产中检查氯气是否泄漏的装置,下列有关说法错误的是
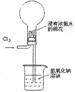 A.烧瓶中立即出现白烟
A.烧瓶中立即出现白烟
B.烧瓶中立即出现红棕色
C.烧瓶中发生的反应表明常温下氨气有还原性
D.烧杯中的溶液是为了吸收有害气体
答案:B
解析:此题考查化学实验、元素化合物的性质等知识。分析装置图,可知氨气和氯气接触时发生反应:4NH3+6Cl2=2NH4Cl+4HCl+N2,烧瓶中出现白烟,A对;不能出现红棕色气体,B错;该反应中氨气中的氮元素化合价升高,表现还原性,C对;烧杯中的氢氧化钠可以吸收多余的有害气体,D对。
知识归纳:对某种元素来讲,其处于最高价时,只有氧化性;处于最低价时,只有还原性;中间价态,则既有氧化性又有还原性。故此对同一种元素可以依据价态判断,一般来讲,价态越高时,其氧化性就越强;价态越低时,其还原性就越强;此题中氨气中的氮元素处于最低价,只有还原性。
[例2](2010上海卷)向盛有KI溶液的试管中加入少许CCl4后滴加氯水,CCl4层变成紫色。如果继续向试管中滴加氯水,振荡,CCl4层会逐渐变浅,最后变成无色。
完成下列填空:
1)写出并配平CCl4层由紫色变成无色的化学反应方程式(如果系数是1,不用填写):

2)整个过程中的还原剂是 。
3)把KI换成KBr,则CCl4层变为__色:继续滴加氯水,CCl4层的颜色没有变化。Cl2、HIO3、HBrO3氧化性由强到弱的顺序是 。
4)加碘盐中含碘量为20mg-50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若庄Kl与
Cl2反应制KIO3,至少需要消耗Cl2 L(标准状况,保留2位小数)。
答案:1)I2+5Cl2+6H2O→2HIO3+10HCl;2)KI、I2;3)红棕、HBrO3>Cl2>HIO3;4)10.58。
解析:此题考查氧化还原反应的配平、氧化剂和还原剂、氧化性强弱的判断、化学计算知识。分析反应从开始滴加少许氯水时,其将KI中的I元素氧化成碘单质;等CCl4层变紫色后,再滴加氯水时,其将碘单质进一步氧化成碘酸。1)根据氧化还原反应方程式的配平原则,分析反应中的化合价变化,I元素的化合价从0→+5,升高5价,Cl元素的化合价从0→-1,降低1价,综合得失电子守恒和质量守恒,可配平出:I2+5Cl2+6H2O→2HIO3+10HCl;2)分析整个过程中化合价升高的都是I元素,还原剂为:KI和I2;3)KI换成KBr时,得到的是溴单质,则其在CCl4中呈红棕色;继续滴加氯水时,颜色不变,可知氯水不能将溴单质氧化成HBrO3,故其氧化性强弱顺序为:HBrO3>Cl2>HIO3;4)综合写出反应方程式:KI+3Cl2+3H2O=KIO3+6HCl,根据化学方程式计算,按最小值计算时,1000kg加碘食盐中含碘20g,根据质量守恒,可知:换算成碘酸钾的质量为:33.70g,物质的量为:0.16mol,则需要消耗Cl2的体积为:(20g/127g.mol-1)×3×22.4L/mol=10.58L。
解法点拨:守恒定律是自然界最重要的基本定律,是化学科学的基础。在化学反应中,守恒包括原子守恒、电荷守恒、得失电子守恒等。任何化学反应在反应前后应遵守电荷或原子守恒。电荷守恒即反应前后阴阳离子所带电荷数必须相等;原子守恒(或称质量守恒),也就是反应前后各元素原子个数相等;得失电子守恒是指在氧化还原反应中,失电子数一定等于得电子数,即得失电子数目保持守恒。比如此题中我们就牢牢抓住了守恒,简化了计算过程,顺利解答。
[例3](2009全国卷Ⅱ13)含有a mol FeBr2的溶液中,通入x mol Cl2。下列各项为通Cl2过程中,溶液内发生反应的离子方程式,其中不正确的是 ( )
A.x=0.4a,2Fe2++Cl2=2Fe3++2Cl-
B.x=0.6a,2Br-+ Cl2=Br2+2Cl-
C.x=a,2Fe2++2Br-+2Cl2=Br2+2Fe3++4Cl-
D.x=1.5a,2Fe2++4Br-+3Cl2=2Br2+2Fe3++6Cl-
答案 B
解析 由于Fe2+的还原性强于Br-,故根据氧化还原反应的先后顺序知,Cl2先氧化
Fe2+,然后再氧化Br-。2Fe2+ + Cl2  2Fe3+ + 2Cl-,2Br- + Cl2
2Fe3+ + 2Cl-,2Br- + Cl2  Br2 + 2Cl-,2FeBr2 +
3Cl2
Br2 + 2Cl-,2FeBr2 +
3Cl2  2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
2FeCl3 + 2Br2 。当x/a ≤0.5时,Cl2仅氧化Fe2+,故A项正确。当x/a ≥1.5时,Fe2+和Br-合部被氧化,D项正确;当介于两者之间时,则要分步书写方程式,然后进行叠加得总反应。如B项,当x=0.5a时,Cl2刚好把Fe2+全部氧化,而当x=0.6a,显然Cl2还要氧化Br-,而选项中没有表示,故错。
|

第2课时 卤族元素
卤族元素
2.盐酸的化学性质: (挥发性强酸的通性)
1.物理性质: 无色、有刺激性气味的气体;极易溶于水 (1:500)其水溶液为盐酸。
4.氯气的制法
 (1)实验室制法
(1)实验室制法
药品及原理:MnO2 + 4HCl(浓) MnCl2 + 2H2O + Cl2↑
强调:MnO2跟浓盐酸在共热的条件下才反应生成Cl2,稀盐酸不与MnO2反应。
仪器装置:发生装置---收集装置---吸收装置
实验步骤:检密—装药—固定—加热—收集
收集方法:向上排空气法 (或排饱和食盐水法)
净化装置:用饱和食盐水除去HCl,用浓硫酸干燥
尾气处理:用碱液吸收
 (2)氯气的工业制法:(氯碱工业)
(2)氯气的工业制法:(氯碱工业)
2NaCl + 2H2O 2NaOH + H2↑ + Cl2↑
3.氯水的成分及性质
氯气溶于水得黄绿色的溶液----氯水。在氯水中有少部分氯分子与水反应,Cl2 + H2O = HCl + HClO (次氯酸),大部分是以Cl2分子状态存在于水中。
注意:(1)在新制的氯水中存在的微粒有:H2O、Cl2、HClO、H+、Cl-、ClO-、OH-;久置氯水则几乎是盐酸溶液
 ① 一元弱酸,比H2CO3弱
① 一元弱酸,比H2CO3弱
(2)HClO的基本性质 ② 不稳定,2HClO === 2HCl + O2↑
③ 强氧化性;
④ 漂白、杀菌能力,使色布、品红溶液等褪色。
(3)几种漂白剂的比较
|
漂白剂 |
HClO |
Na2O2(H2O2) |
SO2 |
活性炭 |
|
漂白原理 |
氧化漂白 |
氧化漂白 |
化合漂白 |
吸附漂白 |
|
品红溶液 |
褪色 |
褪色 |
褪色 |
褪色 |
|
紫色石蕊 |
先变红后褪色 |
褪色 |
只变红不褪色 |
褪色 |
|
稳定性 |
稳定 |
稳定 |
不稳定 |
—— |
2.化学性质:氯气的化学性质很活泼的非金属单质。
(1)与金属反应(与变价金属反应,均是金属氧化成高价态)

如:①2Na+Cl2 2NaCl(产生白烟)
②Cu+Cl2 CuCl2(产生棕黄色的烟)
CuCl2(产生棕黄色的烟)
③2Fe+3Cl2 2FeCl3(产生棕色的烟)
2FeCl3(产生棕色的烟)
注:常温下干燥的氯气或液氯不与铁反应,所以液氯通常储存在钢瓶中。
(2)与非金属反应
如:①H2+Cl2 2HCl(发出苍白色火焰,有白雾生成)——可用于工业制盐酸
2HCl(发出苍白色火焰,有白雾生成)——可用于工业制盐酸
H2+Cl2 2HCl(会发生爆炸)——不可用于工业制盐酸
2HCl(会发生爆炸)——不可用于工业制盐酸
②2P+3Cl2 2PCl3(氯气不足;产生白雾)
2PCl3(氯气不足;产生白雾)
2P+5Cl2 2PCl5(氯气充足;产生白烟)
2PCl5(氯气充足;产生白烟)
(3)与水反应:Cl2+H2O = HCl+HClO
(4)与碱反应
Cl2+2NaOH = NaCl+NaClO+H2O(用于除去多余的氯气)
2Cl2+2Ca(OH)2 = Ca(ClO)2+CaCl2+2H2O(用于制漂粉精)
Ca(ClO)2+CO2+H2O = CaCO3↓+2HClO(漂粉精的漂白原理)
(5)与某些还原性物质反应
如:①2FeCl2+Cl2 = 2FeCl3
②2KI+Cl2 = 2KCl + I2(使湿润的淀粉-KI试纸变蓝色,用于氯气的检验)
③SO2+Cl2+2H2O = 2HCl + H2SO4
(6)与某些有机物反应
 如:①CH4+Cl2 CH3Cl
+ HCl(取代反应)
如:①CH4+Cl2 CH3Cl
+ HCl(取代反应)
②CH2=CH2+Cl2 → CH2ClCH2Cl(加成反应)
1.物理性质:常温下,氯气是黄绿色、有刺激性、能溶于水、比空气重、易液化的有毒气体。
20. A.pushed B.pulled C.dragged D.drew
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com