
6. 某校课外活动小组为了探究铜与稀硝酸反应产生的是NO而设计了一个实验。其装置如图(加热装置和固定装置均已略去)。图中K为止水夹(处于关闭状态),F是一半空的注射器,D是尾气处理装置(兼防倒吸功能)。

请回答下列问题:
(1)设计装置A的目的是 ;为达此目的,应如何操作 ;A中反应的化学方程式为 。
(2)在(1)的“操作”后将装置B中铜丝插入稀硝酸,并微热之,观察到装置B中的现象是 ;B中反应的离子方程式是 。
(3)装置E和F的作用是 ;
为实现此作用,其操作方法是 。
5. 工业制纯碱时的第一步是通过饱和食盐水、氨和二氧化碳之间的反应,获得碳酸氢钠晶体,第二步是利用碳酸氢钠制取纯碱。第一步的反应原理可以用以下的两个化学方程式表示,两个反应的总结果是放热反应。
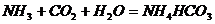
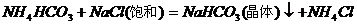
某校学生化学活动小组欲在实验室中模拟制纯碱的第一步过程,以获得碳酸氢钠晶体。可供选择的试剂有: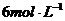 盐酸、
盐酸、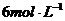 的硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰。该小组学生设计的最简单的实验装置如图:
的硫酸、浓氨水、氢氧化钠、消石灰、石灰石、氯化铵、食盐、蒸馏水和冰。该小组学生设计的最简单的实验装置如图:
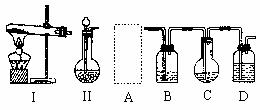
(1)图中空中A处所用装置是(从装置I、II中选择) 。
(2)请写出图中A、B、C、D处各仪器中盛放试剂的名称:A ,B ,C ,D 。
(3)装置D的作用是 。
(4)辅导教师指出要获得较多量的碳酸氢钠晶体,此套装置还有不足之处,请说明其原因并加以改进。
(5)利用本题所提供的试剂(只限一种)及试管、酒精灯等主要仪器,通过简单实验判断该实验得到的产品是碳酸氢钠晶体,而不是碳酸氢铵或食盐晶体,简述操作过程、现象及结论。
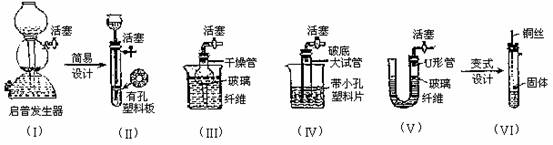
4. 某校化学课外活动小组利用下面所提供的仪器装置和药品制取NaHCO3溶液,设计如下实验。实验室提供的药品、仪器装置如下:① 2% NaOH溶液;② 稀HCl;③ 稀H2SO4;④ 饱和KHCO3溶液;⑤ 浓H2SO4;⑥ CaCO3固体;⑦ K2CO3粉末
仪器装置(如图所示)
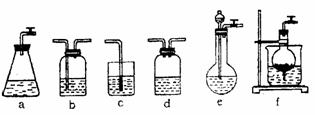
请根据题目要求回答下列问题:
(1)请按下表要求,填写选择的装置和药品。
|
分项 内容 |
CO2发生装置(随开随用,随关随停)(X) |
除杂洗气装置(Y) |
制备产品装置(Z) |
|
选择的装置(填序号) |
|
|
c |
|
选择的药品(填序号) |
|
|
① |
(2)如何检验所选择的CO2发生装置(X)的气密性,请写出主要操作过程: 。
(3)将装置按X、Y、Z顺序连接并检查气密性后,当加入药品实验时,X装置中发生化学反应的离子方程式为 ,Y装置中除去的杂质为 。
(4)常温下,向Z装置的NaOH溶液中通入过量CO2气体,其原因是 ;通入过量CO2后,Z装置内的溶液中离子浓度大小顺序为 ;若要保证Z装置中不析出晶体(不考虑过饱和溶液问题),NaOH溶液浓度不能超过 %(质量分数)。
附:有关物质在常温(20℃)时的溶解度
|
化学式 |
Na2CO3 |
NaHCO3 |
NaOH |
NaCl |
Na2SO4 |
|
溶解度 (g/100g H2O) |
21.3 |
9.60 |
107 |
35.8 |
19.4 |
3. 剪约6cm长、2cm宽的铜片、铝片各一片,分别用接线柱平行地固定在一块塑料板上(间隔2cm),将铜片与铝片分别和电流表的“+”、“-”端相连接,电流表指针调到中间位置。取两个50mL的小烧杯,在一个烧杯中注入约40mL的浓硝酸,在另一只烧杯中注入40mL 0.5mol/L的硫酸溶液。
试回答下列问题:
(1)两电极同时插入稀硫酸中,电流表指针偏向 (填“铝”或“铜”)极,铝片上电极反应式为 ;
(2)两电极同时插入浓硝酸时,电流表指针偏向 (填“铝”或“铜”)极,此时铝是 (填“正”或“负”)极,铝片上的电极反应式为 。
2. 现有酚酞试液、石蕊试液、0.1mol/L氨水、35%盐酸、0.1mol/L盐酸、氢氧化钙固体和蒸馏水,请应用化学平衡知识设计一个实验(只限于选用上述试剂),证明氨水为弱碱,简述方法,并写出有关的离子方程式。
1. 证明CH3COOH为弱酸,现有药品和仪器;冰醋酸,蒸馏水、pH试纸,请你设计实验证明:
(1)设计的理论依据是 ;
(2)简要步骤是: ;
(3)需要记录的数据是 ;
(4)分析推断:由于 ,说明 ,所以CH3COOH是弱酸。
5. 解题的基本思路
明确目的→弄清原理→具体设计→数据处理
[典型例题]
[例1] 铝粉是铝热剂的主要成份之一,常用铝锭制得的铝粉中含有少量的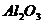 和
和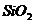 ,用如图所示的装置(甲乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
,用如图所示的装置(甲乙管用橡皮管连接可上下移动)测定铝粉中金属铝的含量,其方法是:用硫酸或氢氧化钠溶液与样品作用,通过产生的气体体积计算样品中金属铝的含量,根据实验原理回答下列问题:
(1)如何检验此装置的气密性 。
(2)从硫酸和氢氧化钠溶液两种试剂中挑选,应选用 较好,理由是 。
(3)装置中导管a所起的作用是 。
A. 保证实验装置不漏气 B. 使分液漏斗中的液体顺利滴下
C. 减少气体体积测定的误差
(4)为了较准确测量产生的气体体积,在反应前后读取甲管液面的读数时应注意 。
A. 反应前读取甲管液面数据时应使甲、乙中液面保持水平
B. 反应后读取甲管液面数据时应使甲、乙中液面保持水平
C. 反应后读取甲管液面数据时,甲、乙两管液面无须保持水平
D. 反应后立即读取甲管液面数据,防止液面变动
E. 反应后静止置一会,待反应器恢复原来温度后再读取数据

解析:该题的实验目的是测定铝粉中金属铝的含量,且通过产生气体的体积经计算求出--是一道定量题,要求实验的准确性。
(1)凡是有气体参加和生成的实验,都必须检验装置的气密性,根据气密性检查的方法。该题应采用注水法--液封法,关闭分液漏斗的旋钮向乙中注水。并记下液面位置,静置一段时间后,看液面是否下移,若仍维持液面高度则气密性良好。
(2)由于样品中含有SiO2,不与硫酸反应,不能确定铝是否反应完全(有部分铝会包裹在SiO2中,使实验结果产生一定误差,则应选择NaOH,使样品全部溶解,Al可充分反应,减少误差。)
答案:
(1)向乙中注水,使之与甲产生液面差,记下乙中液面位置,静置,乙中液面不下移,即可。
(2)NaOH;可使样品全部反应,减少误差。
(3)B
(4)AE
[例2] 四氯化钛是无色液体,沸点为136℃,它极易水解,遇空气中水蒸气即产生“白烟”(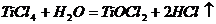 )。四氯化钛可由
)。四氯化钛可由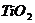 与
与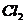 发生置换反应而制得(
发生置换反应而制得(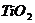 不与HCl反应)。此反应在1000℃高温下进行得很慢,但如果有炭粉存在时,只要650℃-850℃反应便可顺利进行。下面是某同学设计的实验室制备
不与HCl反应)。此反应在1000℃高温下进行得很慢,但如果有炭粉存在时,只要650℃-850℃反应便可顺利进行。下面是某同学设计的实验室制备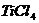 装置:
装置:

请回答:
(1)A装置中反应的化学方程式是 。
(2)B装置中的试剂为 ,其作用是 。
(3)C装置中的反应方程式为 。
(4)D装置中冷凝水的方向为 进 出,该装置的作用为 。
(5)E装置中NaOH溶液的作用是 。
(6)请指出装置的缺陷和不妥之处,并进行改进 。
解析:根据题,该信息和实验装置可知(1)A装置中发生的是实验室制Cl2的反应。因TiCl4“极易水解,遇水蒸气产生‘白烟’”可推知B装置中应为干燥剂--浓H2SO4。又由题中“TiCl4可由TiO2与Cl2发生置换反应而制得”信息可完成(3)问。并根据竖直使用冷凝管的原理,可得冷凝水的进、出方向。由于产生的Cl2不会完全消耗,必须在实验后吸收,防污染环境。缺点在于E装置无排空气孔,D、E间缺干燥器。
答案:
(1)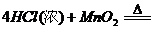
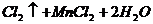
(2)浓H2SO4;吸放Cl2中水蒸气
(3)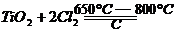
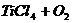
(4)a、b;使TiCl4冷凝回流进入D
(5)吸收Cl2
(6)① E装置无排气孔,应在胶塞上加一支玻璃导管,与大气相通。
② D、E间应加干燥装置
[模拟试题]
4. 装置的改进及一般实验装置的归纳
(1)制备气体的发生装置



(2)气体的净化和干燥

(3)气体的收集方法

(4)尾气的处理装置

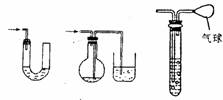
(5)安全瓶
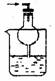
(6)气体体积的测量
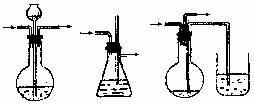
 (7)喷泉实验装置的设计
(7)喷泉实验装置的设计
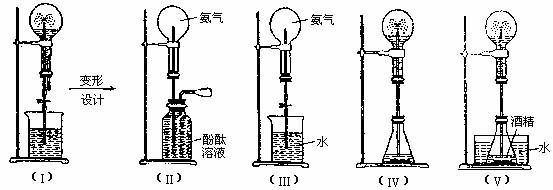
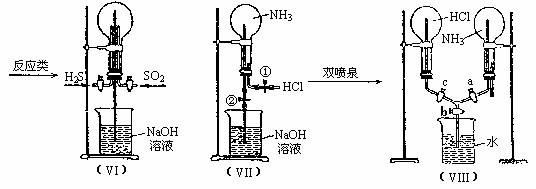
3. 综合实验的创新设计及基本实验原理的灵活应用
2. 综合实验设计的评价:
方案的可制性及优劣
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com