
1.在容量瓶的使用方法中,下列操作中正确的是( )
A. 使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.配制溶液时,如果试样是固体,把称好的试样用纸条小心倒入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管滴加蒸馏水到刻度线
D.配制溶液时,如果试样是液体,用量筒量取试样后直接到入容量瓶中,缓慢加入蒸馏水到接近刻度线2-3cm处,用滴管加蒸馏水到刻度线
4.误差分析:
例1. 在4℃时向100ml水中溶解了22.4L HCl气体(标准状况下测得)后形成溶液。下列说法中正确的是( )
A.该溶液物质的量浓度为10mol/L
B.该溶液物质的量浓度因溶液的密度未知而无法求得
C.该溶液中溶质的质量分数因溶液的密度未知而无法求得
D.所得溶液的体积为22.5L
解析:解此类题的关键在于从定义出发,找源头。气体与液体混合时体积不能简单加和,液体与液体混合,如果给出密度也不能简单加和。溶液的体积不等于溶剂的体积。本题的溶质的质量与溶液的质量可求得:36.5g,100g,所以可求出质量分数。选项A:溶液的体积不能简单等于0.1L,便可推知该溶液物质的量浓度不应等于10mol/L。选项D:溶液的体积不能是溶质与溶剂的简单加和。即不等于22.5L。
答案:B
例2. 某实验中需要90mL0.5mol/L的NaOH溶液,试回答下列问题:
(1)若用NaOH固体配制,求需要NaOH多少克。
(2)若用2mol/L的NaOH溶液配制,求需要此溶液多少毫升。
(3)上述两种配制方法中实验操作有何不同?所需主要仪器有何不同?
解析:首先应明确一点,容量瓶的规格(容积)是不连续的,若所需溶液体积与容量瓶的常见规格不符,则所选的容量瓶规格应大于且尽量接近于所需溶液的体积,所以实验需要90m溶液,应选大于90mL而又最接近于90mL的常见规格100mL容量瓶,并按100mL溶液进行计算。
其次,在溶液配制前的计算中,应抓住溶质的质量(或物质的量)守恒这一特点进行计算,即配制后溶液中所含溶质质量等于配制前的固体(不含结晶水)质量或浓溶液中的溶质质量。
(1)m (NaOH ) = 0.5mol/L×0.1L×40g/mol = 2g
(2)设需2mol/L NaOH溶液 x mL
则有 x /1000L×2mol/L=100/1000 L×0.5mol/L
解之得:x =25mL
(3)用溶质固体配制时,计算其用量后所需操作是“称量”,所需仪器是“天平”,用浓溶液配制时,计算其用量后所需操作是“量取”,所需仪器是“量筒”或碱式滴定仪。
[基础训练]
3.配制一定物质的量浓度的溶液通常要有以下几个步骤:计算、称量、溶解、转移、洗涤、定容、摇匀。
2.容量瓶是用于配制 体积 浓度的溶液的容器,在使用之前必须先 。其瓶颈上有一道 ,瓶壁上标有 和 ,
此三者的含意是 。所以,在配制溶液过程中,热或冷的溶液一定要 后才能转移到容量瓶中。
1.溶液中溶质的质量分数是指 。
溶液中溶质的物质的量浓度是指 ,
用符号 表示,常用单位为 ,计算公式___________。
2. 学会配制一定物质的量浓度溶液的实验技能
教学重点。难点: 物质的量浓度的计算
一定物质的量浓度溶液的配制
教学过程:
1、认识物质的量浓度的概念
2.下列说法正确的是(NA表示阿佛加德罗常数)
A.在常温常压下,11.2LN2含有的分子数为NA
B.在标准状况下,18gH2O所占的体积约是22.4L
C.32gO2在标准状况下所占的体积约为22.4L
D.在同温同压下,相同体积的任何气体单质所含有的原子数相同
教学目标
1. 在同温同压下,两种物质的量相同的单质气体之间的关系正确的是
A.体积都是22.4L B.具有相同的体积
C.都是双原子分子 D.具有相同的分子数目
3.阿伏伽德罗定律:在相同温度、压强下,相同体积的任何气体都含有相同数目的分子。
(小结)
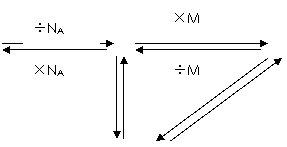
|
(练习)
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com