
22.(10分)海水中有非常丰富的化学资源,从海水中可提取多种化工原料。下图是某工厂对海水资源综合利用的示意图。
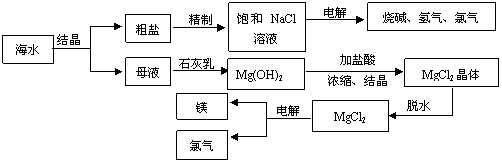
试回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质,精制后可得到包含NaCl溶液。精制时通常在溶液中依次加入过量的________溶液、过量的__________溶液、过量的______溶液,过滤后向滤液中加入盐酸至溶液呈中性。加入盐酸后,滤液中可能发生反应的离子方程式为_______________________; 。
(2)海水提取食盐后的母液中有K+、Na+、Mg2+等阳离子。加入石灰乳的作用是 。
(3)以海滩贝壳为原料制取Ca(OH)2的过程可用化学方程式表示为________________;
。
(4)MgCl2 ·6H2O脱水过程中易水解生成碱式氯化镁,化学方程式式为___________。因此工业上常使用MgCl2 ·6H2O晶体在________气氛中脱水而得到无水的MgCl2。
21.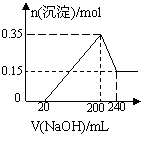 (6分)将一定量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
(6分)将一定量的Mg和Al的混合物投入500mL稀硫酸中,固体全部溶解并产生气体。待反应完全后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示:
(1)固体混合物中Mg的质量分数为___________,Al的质量分数为__________。
(2)NaOH溶液的物质的量浓度为____________。
20.(18分)常温下在20 mL 0. mol·L-1 Na2CO3溶液中逐滴加入0.1 mol·L-1 HCl溶液40 mL,溶液的pH值逐渐减小,溶液中含碳元素的微粒的物质的量分数(纵坐标)随溶液pH所发生的变化如图所示(CO2因逸出而未画):
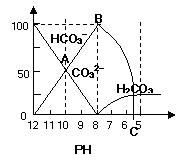 请回答下列问题:
请回答下列问题:
(1)在0.1 mol·L-1 Na2CO3溶液中,c(Na+):c(CO32―)___2 (填“<”或“<”或“=”);该溶液中所有阳离子和阴离子浓度的关系__________(用等式回答)。
(2)在20 mL 0.1 mol·L-1 Na2CO3溶液中加入BaCl2粉末3.328×10-7g时开始产生沉淀BaCO3,则
Ksp(BaCO3)=c(Ba2+)×c(CO32-)=______________。
(3)当加入盐酸使溶液pH为10时,混合溶液中碳溶液含碳元素的离子有 ,其物质的量之比为_______________。
(4)随着盐酸的加入,HCO3-的浓度变化趋势是_________________,其中,OAB段的离子方程式为______________;BC段的离子方程式为______________。
(5)当混合溶液的pH=_________(填整数)时,开始逸出CO2气体。
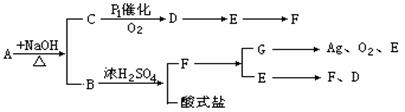
19.(7分)框图中A是一种无机盐,根据图中的关系(各反应中生成的水已略去),确定各物质的分子式:
A 、B 、C 、D 、E 、F 、G 。
18. (7分)Cu、Cu2O和CuO组成的混合物,加入100mL 0.6 mol·L-1 HNO3溶液恰好使混合物溶解,同时收集到224mL NO气体(标准状况)。
(1)Cu2O跟稀硝酸反应的化学方程式为 。
(2)产物中硝酸铜的物质的量为_______mol。
(3)如混合物中含有0.01 mol Cu,则其中Cu2O、CuO的物质的量分别为______ mol ____mol。
 (4)如混合物中Cu的物质的量为x,则其中Cu2O、CuO的物质的量及x的取值范围为_______、_______、_________。
(4)如混合物中Cu的物质的量为x,则其中Cu2O、CuO的物质的量及x的取值范围为_______、_______、_________。
17.(12分)(1)一定量的NaOH和NaHCO3混合物X,放在密闭容器中加热,充分反应后生成CO2气体V1 L(≠0)。将反应后的固体残渣Y与过量的盐酸反应又生成V2 L CO2气体,气体体积均在标准状态下测定。
①Y的化学式是________。
A.Na2CO3、NaOH B.Na2CO3、NaHCO3 C.Na2CO3 D.NaOH
②X中NaOH、NaHCO3物质的量之比为 。
(2)①常温下A与B两种气体组成的混合物(A的式量大于B的式量),经分析混合气体中只含碳和氢两种元素,而且不论A和B以何种比例混合,碳和氢的质量比总小于12∶4,由此可确定A为__________;B为_________;其理由是______ __________。
②若上述混合气体中碳和氢质量比为6∶5,则在混合气体中A和B的物质的量之比是 ,A在混合气体中的体积分数为_____________。
16. 某学生鉴定甲盐的发如图所示:
某学生鉴定甲盐的发如图所示:
下列结论正确的是( )
A.甲中一定有Fe3+ B.丙中一定有Fe3+
C.乙为AgI沉淀 D.甲一定为FeBr2溶液
15.不能正确表示相应反应的离子方程式是( )
A.向碳酸氢铵溶液中滴加过量的氢氧化钠溶液:HCO3-+NH4++2OH-=CO32-+H2O +NH3·H2O
B.硝酸亚铁溶液中滴加盐酸:3Fe2++4H++NO3-=3Fe3++2H2O+NO↑
C.少量固体Mg(OH)2溶于饱和NH4Cl溶液中:2NH4++Mg(OH)2=2NH3·H2O+Mg2+
.... D.用惰性电极电解MgCl2溶液:2Cl-+2H2O  H2↑+Cl2↑+2OH-
H2↑+Cl2↑+2OH-
14.下列离子方程式表示正确的是( )
A.AgNO3溶液中加入Cu:Cu+Ag+=Cu2++Ag
B.NaHCO3溶液中加入CH3COOH:CO32-+2CH3COOH=CO2↑+2CH3COO-+H2O
C.0.1molFeBr2溶液中通入足量Cl2:2Fe2++2Br-+2Cl2=2Fe3++Br3+4Cl-
D.等体积等物质的量浓度的NaHCO3和Ba(OH)2两溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O
13.某些金属卤化物可跟其卤素反应,如KI+I2 KI3(KI3易溶于水)。下列推断错误的是( )
KI3(KI3易溶于水)。下列推断错误的是( )
A.I3-溶液存在如下平衡:I3- I2+I-
I2+I-
B.在KI3溶液中加入AgNO3溶液,会析出AgI3沉淀
C.KI3溶液可用于检验淀粉的存在
D.在配制碘水时,加入KI可增大I2的溶解度
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com