
5. (2008学年第一学期十校高三期末联考数学试题(文))在平面直角坐标系中, 不等式组 (a∈[-2,2])表示的平面区域面积是f(a), 那么f(a)的图像可能是( )
A. B. C. D.
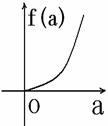
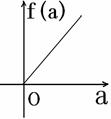
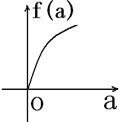
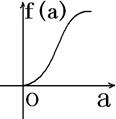
答案:A (第5题图)
4.(宁波市2008学年度第一学期高三期末数(理))已知点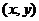 满足x+y≤6,y>0,x-2y≥0,则
满足x+y≤6,y>0,x-2y≥0,则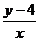 的最大值为
的最大值为
(A)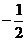 (B)
(B)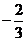 (C)0 (D)不存在
(C)0 (D)不存在
答案:A
3.(2008学年第一学期十校高三期末联考数学试题(理)) 在平面直角坐标系中, 不等式组 (a为常数)表示的平面区域面积是9, 那么实数a的值为( )
A. 3+2 B. -3+2 C. -5 D.1
答案:D
2.(温州市十校2008学年高三第一学期期初联考 数学试题(文))已知实数a、b满足条件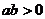 ,则下列各式中正确的是(
)
,则下列各式中正确的是(
)
A.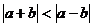 B.
B.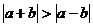
C.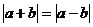 D.
D.
答案:B
1. (2009年浙江省杭州市第一次高考科目教学质量检测数学试题题(文))下列不等式不一定成立的是
(A) 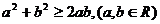 (B)
(B) 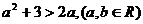
(C) 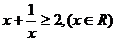 (D)
(D) 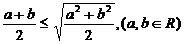
答案:C
1(宁波市2008学年度第一学期期末试卷高三数学(理科))
已知点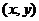 满足x+y≤6,y>0,x-2y≥0,则
满足x+y≤6,y>0,x-2y≥0,则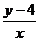 的最大值为
的最大值为
(A)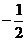 (B)
(B)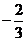 (C)0 (D)不存在
(C)0 (D)不存在
1. A
2(2008学年金丽衢十二校高三第一次联考数学试卷(理科))
.若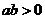 ,则条件“
,则条件“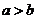 ”是“
”是“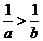 ”的
”的
A.充分而不必要条件 B.必要而不充分条件
C.充要条件 D.既不充分也不!必要条件
D
3(浙江省杭州市2009年期末考试)3.下列不等式不一定成立的是( )C
A.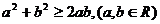 B.
B.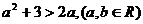
C.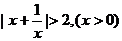 D.
D.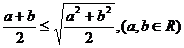
4(浙江省金华十校2008-2009学年高三第一学期期末考试)
已知点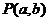 与点Q(1,0)在直线
与点Q(1,0)在直线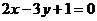 的两侧,则下列说法中:
的两侧,则下列说法中:
①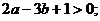 ②
②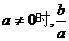 有最小值,无最大值;
有最小值,无最大值;
③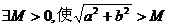 恒成立;④
恒成立;④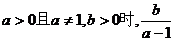 的取值范围
的取值范围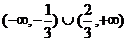 ,正确的应该是 ( D )
,正确的应该是 ( D )
A.①② B.②③ C.①④ D.③④
(1)不同类型的晶体:一般而言,熔、沸点高低顺序为原子晶体>离子晶体和金属晶体>分子晶体
(2)同类晶体:
①原子晶体的熔、沸点取决于共价键的键长和键能,键长越短、键越大,熔、沸点越高,如金刚石>金刚砂>晶体硅
②离子晶体的熔、沸点取决于离子键的强弱,通常离子半径越小、离子所带电荷数大,离子键越强,熔、沸点高,如KF>KCl>KBr、NaCl>KCl;
晶格能是指 形成1摩离子晶体释放的能量,通常取正值,晶格能越大,形成的离子晶体越 ,且熔沸点
③分子晶体的熔、沸点取决于分子间作用力的大小,通常分子极性越强、相对分子质量越大,分子间作用力越强,熔、沸越高,有氢键的分子晶体,还要考虑氢键的强弱
④同类金属晶体中,金属离子半径越小,阳离子带电荷数越高,金属键越强,熔、沸点越高,如Li>Na>K, Na<Mg<Al
试题枚举
[例1]晶体具有各向异性。如蓝晶石(Al2O3·SiO2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。晶体的各向异性主要表现在是:( )
①硬度 ②导热性 ③导电性 ④光学性质
A.①③ B.②④ C.①②③ D.①②③④
答案:D
[例2]下列属于分子晶体的一组物质是
A. CaO、NO、CO B .CCl4、H2O2、He
C .CO2、SO2、NaCl D .CH4、O2、Na2O
解析:固态金属是金属晶体;大多数的盐、碱和金属氧化物是离子晶体;熟记常见的原子晶体;其它常见物质大多是分子晶体
答案:B。
[例3]下列性质符合分子晶体的是
A . 熔点1070℃,易熔于水,水溶液能导电
B. 熔点是10.31℃,液体不导电,水溶液能导电
C. 熔点97.81℃,质软,能导电,密度是0.97g/cm3
D. 熔点973℃,熔化时能导电,水溶液也能导电
解析:A、D中的物质熔点较高,D中物质熔化时能导电,都是离子化合物;C中物质固态能导电,应为金属单质
答案:B
[例4]下列大小关系正确的是( )
A.晶格能:NaCl<NaBr B.硬度:MgO>CaO
C.熔点:NaI>NaBr D.熔沸点:CO2>NaCl
解析:离子半径 Cl-<Br- 离子键 NaCl>NaBr,晶格能NaCl>NaBr,A项错误;MgO、CaO均为离子晶体,离子半径Mg2+<Ca2+,MgO中离子键强,键能大,晶格能大,硬度大,B正确;C类似;D中CO2分子晶体,NaCl是离子晶体,熔沸点:CO2<NaCl
答案:B
[例5]金属能导电的原因是
A. 金属晶体中金属阳离子与自由电子间的相互作用较弱
B.金属晶体中的自由电子在外加电场作用下可发生定向移动
C.金属晶体中的金属阳离子在外加电场作用下可发生定向移动
D.金属晶体在外加电场作用下可失去电子
解析:金属晶体中金属阳离子与自由电子间的相互作用属于静电作用,是强烈的相互作用,A错误;金属晶体在外加电场作用下电子定向移动,不会失去。
答案:B
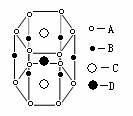
[例6]现有甲、乙、丙、丁四种晶胞(如图所示),可推知:甲晶体中A与B的离子个数比为 ;乙晶体的化学式为 ;丙晶体的化学式为______;丁晶体的化学式为______。
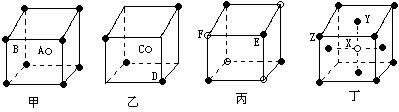
解析:立方晶胞体心的微粒一个晶胞所有,面心的微粒为两个晶胞是共有,每个微粒有1/2属于该晶胞,棱边的微粒为4个晶胞共有,每个微粒有1/4属于该晶胞,顶点的微粒为个8晶胞共有,每个微粒有1/8属于该晶胞。
答案:1∶1 C2D EF XY3Z
2.常见晶体的结构
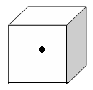 在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为 ;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
在金刚石的晶体结构中每个碳原子与周围的4个碳原子形成四个碳碳单键,这5个碳原子形成的是
结构,两个碳碳单键的键角为
,其中的碳原子采取 杂化,金刚石晶体中C原子数与C-C键数之比为 ,晶体中最小的环上上的碳原子数为 ;石墨晶体中C原子数与C-C键数之比为 ;NaCl晶体中Na+的配位数为 ,Cl-的配位数为 ,每个Na+的周围距离最近且相等的Na+的个数为 ,CsCl晶体中Cs+的配位数为 ,Cl-的配位数为 ,每个Cs+的周围距离最近且相等的Cs+的个数为 ;二氧化硅晶体中每个硅原子与 个氧原子相连,在二氧化硅晶体中最小的环中有 个原子,1mol二氧化硅晶体中,Si-O的数目为 。
思考:右图是二氧化硅晶体的一部分,立方体体心的黑点表示一个硅原子,
在图中画出与硅原子相连的氧原子所在的位置。
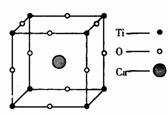
1.概念:描述 叫做晶胞;整块晶体由晶胞“无隙并置”而成;晶胞①中Ti、O、Ca原子数分别为 、 、 ;晶胞②中A、B、C、D原子数分别为 、 、 、 。
分子晶体中分子间尽可能采用紧密排列方式,分子的排列方式与其形状的关;离子晶体可视为不等径圆球的密堆积,离子晶体中正负离子的配位数主要由正负电荷的 (几何因素)、正负电荷的 (电荷因素)以及离子键的纯粹程度(键性因素)决定;金属晶体的结构可以归结为等径圆球的堆积,可分为Po的简单立方堆积、 型、 型和 型。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com