
1. D;2.A;3.B;4.C;5.A;6.D;7.C;
4.甲:不严密。因含有Ag+而不含SO42-的无色溶液也会出现此方案的现象。
乙:严密。因为只有含SO42-的无色溶液才会出现此
方案的现象。
丙:不严密。因为含有SO32-而不含SO42-的无色溶液
也会出现此方案的现象。
讲析:从Ag+、SO32-的存在对SO42-检验的干扰来分析。
检测提高
1. D;2.C;3.C
讲析:1.浓硫酸中加入过量铜片并加热,被还原的
硫酸为0.9mol,实际参加反应的为1.8mol,硫酸变稀后与Cu并不反应,加入的硫酸应大于1.8mol,体积大于100ml。2.大气污染物常见的有SO2、SO3、H2S、煤烟、氮的氧化物(如NO、NO2等);碳的氧化物(C0、C02)、粉尘、碳氢化合物,CO2无毒但造成温室效应。3.绿色食品与食品颜色无关,与香甜无关,不含化学添加剂。
9.SO2与H2的体积比为1:4。
讲析:反应后的溶液稀释至1L,溶液中c(H+)=0.1mol/L,反应后剩余硫酸0.05mol。因浓硫酸在与Zn反应过程中会变稀,将产生SO2与H2两种气体。列方程组解题。
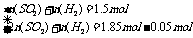
解得: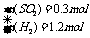
第23课时 (B卷)
纠错训练
1.B;2.D;3.C、D;4.B;5.A、D;6.C;7.A、B;8.D。
讲析:1.潮汐、大脖子病与环境污染无关。2.由题意形成的沉淀可以是AgCl或BaSO4,如原溶液存在SO32,形成的BaSO3能被硝酸氧化成BaSO4。3.C、D中既生成硫酸盐又有SO2气体,浓硫酸既表现强氧化性,又表现酸性。4.被还原的硫酸的量既可以由铜的量又可以由SO2的量来确定。5.98%的浓H2SO4中,硫酸为98g,水为2g,即1mol、1/9mol,H2SO4又可以拆成 SO3和 H2O。6.从三种物质的化学式并结合元素的式量可知:硫元素的质量分数为a%,则Na、H、Mg三元素占0.75a% ,从而求得氧的质量分数。7.长期置露于空气中,亚硫酸钠被氧化成硫酸钠 、浓硫酸吸收水分质量均增加。8.将硫铁矿粉碎燃烧将更充分速率更快;净化SO2是防止催化剂中毒;催化剂只提高反应速率而不能提高转化率。
4.(1) ;(2)7%。
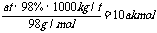 讲析:(1)首先要读懂题意,与通常硫酸工业制法不同的是,本题中是以硫为原料,涉及的反应也较简单,就是:S+O2==SO2,该反应前后气体体积相等,又因为硫酸的物质的量与SO2的物质的量相等,与反应了的O2的物质的量也相等。
讲析:(1)首先要读懂题意,与通常硫酸工业制法不同的是,本题中是以硫为原料,涉及的反应也较简单,就是:S+O2==SO2,该反应前后气体体积相等,又因为硫酸的物质的量与SO2的物质的量相等,与反应了的O2的物质的量也相等。
n(H2SO4)= 。
V(SO2)= V(O2)=224am3,故该厂每小时消耗标准状况
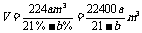
下空气的体积为
(2)因催化氧化时不再补充空气,由反应:
2SO2+O2==2SO3;第二步消耗的氧气是第一步的一半。故b%的下限等于7%。
新活题网站
3.(1)2CO+2NO 2CO2+N2;
(2)SO2转化为SO3,产生硫酸酸雾;
(3)a、 b。
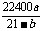 讲析:(1)根据题意,CO与NO反应,生成可参与大气生态环境循环的无毒气体,必然是CO2和N2;(2)SO2被氧化为SO3,与水蒸气产生硫酸酸雾;(3)控制城市空气污染源的方法中,植树造林这一项有一定的迷惑性,植树造林能控制CO2的量,而对消除汽车尾气中的烃类、CO、SO2与NO等物质无直接的效果。
讲析:(1)根据题意,CO与NO反应,生成可参与大气生态环境循环的无毒气体,必然是CO2和N2;(2)SO2被氧化为SO3,与水蒸气产生硫酸酸雾;(3)控制城市空气污染源的方法中,植树造林这一项有一定的迷惑性,植树造林能控制CO2的量,而对消除汽车尾气中的烃类、CO、SO2与NO等物质无直接的效果。
2.(1)2Cu+O2+2H2SO4==2CuSO4+2H2O;
(2)3.75 kg; (3)①2∶5;②y=4。
讲析:(1)由题给信息直接写化学方程式。
(2)用关系式解题:Cu→CuSO4·5H2O
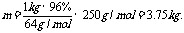
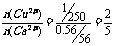
(3)①
②CuSO4+Ca(OH)2==Cu(OH)2+CaSO4
反应前 2 5 0 0
反应后 1 4 1 1
 ∴ CuSO4·Cu(OH)2·yCa(OH)2中 y=4
∴ CuSO4·Cu(OH)2·yCa(OH)2中 y=4
1.(1)不能;在酸性溶液中,NO3-将SO32-氧化成SO42-,造成结果错误。 (2)保证得到的沉淀全部是BaSO4而没有BaSO3。 (3)连续两次称量的质量不变。 (4)
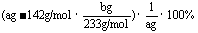
讲析:(1)因先加了稀盐酸,若再加入Ba(NO3)2,SO32-将被氧化成SO42-。(2)如果不是强酸性,BaSO3也能沉淀下来。(3)所谓沉淀的质量“合格”就是质量不再发生变化,以保证水份全没有了。(4)思路是由BaSO4的质量得到Na2SO4的质量,再求Na2SO3的质量,最后求得质量分数。
17.硫铁矿高温下空气氧化产生二氧化硫:
4FeS2+11O2→8SO2+2Fe2O3
设空气中N2、O2的含量分别为0.800和0.200(体积分数,以下气体含量均用体积分数表示),试完成下列各题:
(1)1.00mol FeS2完全氧化,需要空气的体积(标准状况)为 L?
(2)55L空气和足量FeS2完全反应后,气体体积
(同温同压)变为 L?
(3)用空气氧化FeS2产生的气体混合物中,O2的含量为0.0800,计算SO2的含量。
(4)设FeS2氧化产生的气体混合物为100L,其中O2为aL,SO2为bL。
① 写出a和b的关系式
② 在下图中画出a和b的关系曲线(FeS2氧化时,空气过量20%)。说明:为方便作图,纵坐标用13b表示
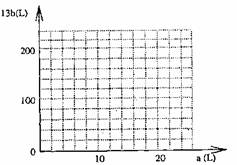
,55
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com