
1.D 2.BD 3.BD 4.D 5.D 6.B
讲析:1.第一步反应:C(s)+H2O(g)
 CO(g)+H2(g) ;△H>0,是吸热反应,降低温度平衡左移;生成的CO量少,不利于提高CO的转化率,故①不对。增大CO 浓度,其转化率也不可能提高。此题选D。 2.应注意化学平衡移动原理和化学反应速率理论的应用范围。B中加催化剂只能提高反应速率。D中合成氨的反应是放热反应,升高温度反应速率加快,平衡左移。 3.寒冷季节易诱发关节疼痛,说明降低温度易形成尿酸钠晶体,则反应②是放热反应,故选BD。 4.平衡气体平均相对分子质量为2×4.25=8.5,而向右反应结果,物质的量增加,平均相对分子减小。根据平衡中可逆反应的不完全转化特征n(A)>
CO(g)+H2(g) ;△H>0,是吸热反应,降低温度平衡左移;生成的CO量少,不利于提高CO的转化率,故①不对。增大CO 浓度,其转化率也不可能提高。此题选D。 2.应注意化学平衡移动原理和化学反应速率理论的应用范围。B中加催化剂只能提高反应速率。D中合成氨的反应是放热反应,升高温度反应速率加快,平衡左移。 3.寒冷季节易诱发关节疼痛,说明降低温度易形成尿酸钠晶体,则反应②是放热反应,故选BD。 4.平衡气体平均相对分子质量为2×4.25=8.5,而向右反应结果,物质的量增加,平均相对分子减小。根据平衡中可逆反应的不完全转化特征n(A)>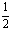 n(平),故M(A)<2M(平)=17。 5.根据固定体积的密闭容器内温度不变,混合气体的压强增大和“X”浓度减小,可知化学平衡向正反应方向移动,得4+3<2+n,n>5,据选项可知n=6。
n(平),故M(A)<2M(平)=17。 5.根据固定体积的密闭容器内温度不变,混合气体的压强增大和“X”浓度减小,可知化学平衡向正反应方向移动,得4+3<2+n,n>5,据选项可知n=6。
3.(1)正反应,7.0 (2)不相等,因题中有“x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器的正中位置”,所以当x=4.5时或5.0时,达到平衡的温度一定不同,因平衡条件不同,平衡时A的物质的量一定不同。
讲析:(1)反应器左侧的反应为一个反应前后总体积不变化的反应,总物质的量始终为nA+nB+nC=4mol+4mol+4mol=12mol,这就要求反应器右侧也必须始终保持总的物质的量为12mol。当x=4.5时,右侧反应在起始时总的物质的量为6.5mol+4.5mol+2mol=13mol,大于12mol,此时反应向总体积缩小的方向移动,即向正反应方向进行。由于右侧的正反应是一个体积缩小的反应,E物质参与反应的越多,体积缩小的越多。设平衡时D物质消耗量为amol。
D + 2E  2F
2F
起始时: 6.5 x 2.0
变化量: a 2a 2a
平衡时:6.5-a x-2a 2.0+2a
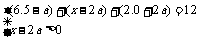 解得 x<7.0
解得 x<7.0
新活题网站
2.A、D
讲析:
X(g)+a Y(g)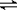 b Z(g)
b Z(g)
反应前物质的量(mol) 1 a 0
反应后物质的量(mol) 1-1×50%=0.5 0.5a 0.5b
反应前气体总物质的量为(1+a)mol
反应后气体总物质的量为(0.5+ 0.5a+0.5b)mol
按定义,密度、质量、体积之间的关系为d=m/V,题设情境气体的总质量m未变,所以气体密度d与体积V成反比,在同温同压下,按照阿伏加德罗定律,V又与气体总物质的量成正比,因此密度与气体总物质的量成反比。据此列式
(1+a):(0.5+ 0.5a+0.5b)=1: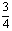 ,化简成1+a=2b
,化简成1+a=2b
将选项中的各a、b值代入可见,只有A、D项的等式成立。
1.(1)3H2S+2Fe(OH)3=Fe2S3+6H2O (2)2.7n (3)b
(4)生产纯碱(或作制冷剂等)
 (5)
(5)
15.丙酮和碘在酸性溶液中发生下列反应:CH3COCH3+I2 → CH3COCH2I +H+ +I-。 25℃ 时,该反应的速率由下列经验式决定:v=2.73×10-5c(CH3COCH3)c(H+) mol/(L•s)。
25℃时,如果c(I2)、c(CH3COCH3)、c(H+)的起始浓度依次是0.01mol/L、0.1mol/L、0.01mol/L,求:
(1)反应开始时的速率是多少?
(2)当溶液中的I2消耗一半时,反应速率比开始时慢还是快?
14. Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)
Fe3+和I-在水溶液中的反应如下:2I-+2Fe3+ 2Fe2++I2(水溶液)
(1)该反应的平衡常数K的表达式为:K=
当上述反应达到平衡后,加入CCl4萃取I2,且温度不变,上述平衡 移动(选填:向右、向左、不)。
(2)上述反应的正向反应速率和I-、Fe3+的浓度关系为:υ=κ{c(I-)}m{c(Fe3+)}n(κ为常数)
|
|
c(I-)(mol/L) |
c(Fe3+)
(mol/L) |
(mol/L·s) |
|
(1) |
0.20 |
0.80 |
0.032κ |
|
(2) |
0.60 |
0.40 |
0.144κ |
|
(3) |
0.80 |
0.20 |
0.128κ |
通过所给的数据计算得知:在υ=κ{c(I-)}m{c(Fe3+)}n中。m、n的值为 [选填(A)、(B)、(C)、(D)]
(A)m=1,n=1 (B)m=1,n=2
(C)m=2,n=1 (D)m=2,n=2
I-浓度对反应速率的影响 Fe3+浓度对反应速度的影响。(选填:小于、大于、等于)
13.在2L容器中,放入0.4molA和0.6molB,在一定温度下,压强为P,放入催化剂(体积忽略)发生反应:2A(g)+3B(g) x C(g)+2D(g),在amin后,容器中c(A)=0.1mol∕L。
x C(g)+2D(g),在amin后,容器中c(A)=0.1mol∕L。
(1)若温度与压强均未改变,求v(B)和x的值;
(2)若温度不变,压强变为9/10P,求v(C)和x 的值。
12. 某溶液中发生反应:A
某溶液中发生反应:A 2B+C,VA-t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
2B+C,VA-t 的关系如图。已知溶液的体积为2L,起始时体系中只有A,请回答下列问题:
(1)图中阴影部分的面积表示2min内 的减小值,应小于 ;
(2)2min时,B的物质的量浓度的取值范围是 。
11.A、B两种气体物质在容器中进行反应,A+3B 2C,10℃时反应速率vB为0.3 mol·(L·s)-1,50℃时反应速率vA=25.6
mol·(L·s)-1,每升高10℃,该反应速率增至原来的
倍。
2C,10℃时反应速率vB为0.3 mol·(L·s)-1,50℃时反应速率vA=25.6
mol·(L·s)-1,每升高10℃,该反应速率增至原来的
倍。
10.反应A+3B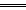 2C+2D在四种不同情况下的反应速率分别为:
2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·(L·s)-1 ②v(B)=0.6 mol·(L·s)-1
③v(C)=0.4 mol·(L·s)-1 ④v(D)=0.45 mol·(L·s)-1
该反应进行的快慢顺序为 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com