
4.硅酸盐工业简介
以含硅物质为原料,经加工制得硅酸盐产品的工业称硅酸盐工业。如烧制瓦、砖、烧制陶瓷等都属硅酸盐工业。硅酸盐工业一般所说硅酸盐工业主要是水泥工业和玻璃工业的原理包含复杂的物理、化学变化。
水泥的原料是粘土和石灰石,主要成分硅酸三钙、铝酸三钙和硅酸二钙。
玻璃的原料是纯碱、石灰石和石英,主要成分是硅酸钠、硅酸钙和二氧化硅。
典型题点击
3. 硅酸、硅酸盐
硅酸不溶于水,溶于强碱,其酸性比碳酸弱。
硅酸及其缩水而成的各种酸所对应的盐统称硅酸盐。
硅酸盐结构复杂,常用氧化物的形式来表示组成。其表示方式: 活泼金属氧化物·较活泼金属氧化物·二氧化硅·水。
2. 二氧化硅
二氧化硅的物理性质
二氧化硅是一种坚硬难溶的固体,天然的二氧化硅也叫硅石。石英、水晶、沙子主要成分是二氧化硅。
二氧化硅的化学性质
(1).酸性氧化物的性质
二氧化硅是酸性氧化物,不溶于水,不与水反应。与碱性氧化物、强碱、碳酸盐等反应
(2).弱氧化性 与碳在高温下反应
(3).特性 与氢氟酸反应。氢氟酸用于雕刻玻璃。
二氧化硅的用途
二氧化硅是制造光导纤维的主要原料;石英用于制石英玻璃、石英电子表、石英钟等。
1.硅
硅的存在 在地壳里,硅的含量在所有元素中居第二位,仅次于氧,全部以化合态存在。硅有晶体硅和无定形硅两种同素异形体。
硅的主要物理性质
晶体硅是灰黑色,有金属光泽,硬而脆的固体,它的结构类似于金刚石,熔沸点较高,是良好的半导体材料。
硅的化学性质
在常温下,硅的化学性质不活泼,除氟气、氢氟酸和强碱外,硅不跟其它物质(如氧气、氯气、硫酸、硝酸)起反应。在加热条件下,硅能跟一些非金属反应。
硅的工业制法
在工业上,用碳在高温下还原二氧化硅的方法制得含少量杂质的粗硅。
 SiO2+3C
SiC+2CO↑
SiO2+3C
SiC+2CO↑
24.(1)5Fe2+ + MnO4- + 8H+ = 5Fe3+ +Mn2+ + 4H2O
(2)Sn% = 77.7%
讲析:(2)
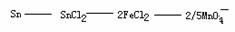
1 2/5
n(Sn) 0.0016mol
n(Sn)= 0.004mol
m(Sn)= 0.476g
Sn% = 77.7%
23. (1)K2O%:11.7% CaO%:13.9% SiO2%:74.4%
(2)K2O·2CaO·10SiO2
22. 244g
21. (1)E、F,D、C,A、B,J、I,H、G。
(2)黑色的氧化铜固体变成红色固体,白色硫酸铜固体变成蓝色固体。
20. Si、H2、SiO2、SiH4、H4SiO4、Na2SiO3
19.
|
NaOH溶液 |
CO2+2NaOH=Na2CO3+H2O |
|
CuO(加热) |
CuO+CO  Cu+CO2 Cu+CO2 |
|
通CO2 |
Na2CO3+CO2+H2O=2NaHCO3 |
|
NaOH溶液 |
2NaOH+SiO2=Na2SiO3+H2O |
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com