
2.(2000年广东高考题)用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.加热 B.不用稀硫酸,改用98%浓硫酸 C.滴加少量硫酸铜溶液 D.不用铁片,改用铁粉
(该题旨在考查学生对影响化学反应速率因素的掌握情况。答题时要综合考虑多方面的因素,注意反应的本质。)
1.反应4A(s)+3B(g) 2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
2C(g)+ D(g),经2min,B的浓度减少0.6mol/L。对此反应速率的表示正确的是( )
A.用A表示的反应速率是0.4 mol·(L·min)-1
B.分别用B、C、D表示的反应速率其比值是3:2:1
C.在2min末的反应速率,用B表示是0.3 mol·(L·min)-1
D.在这2min内用B和C表示的反应速率的值都是逐渐减小的
(本题考查学生对反应速率的理解及表示方法。答题时注意是用何种物质表示反应速率的,指的是平均速率还是瞬时速率。)
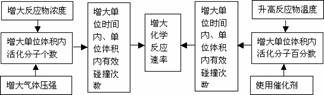
3.外界条件对反应速率的影响,可以概括为“加加、减减”四个字,即增加浓度、增加(升高)温度、增加压强、增加(使用正)催化剂,均可以增大化学反应速率;减小浓度、减小(降低)温度、减小压强、减小(使用负)催化剂,均可以减小化学反应速率。
典型题点击
2.影响化学反应速率的因素
(1)内因(主要因素):参加反应物质的性质。
(2)同一化学反应的速率大小与外界条件(外因)有关。具体规律如下:
1.化学反应速率表示法
(1)意义:研究化学反应进行的快慢问题。
(2)表示方法:常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。单位:mol·(L·min)-1或mol·(L·s)-1。
(3)注意问题
①随着反应的进行,物质浓度不断变化,反应速率也不断变化,因此某一段时间的反应速率实际是平均速率,而不是瞬时速率。
②同一反应里,用不同物质表示的化学反应速率之比,等于它们在化学方程式中的化学计量数之比,也等于同一时间内各物质的浓度变化之比。表示化学反应速率时,应注明是用哪种物质表示的化学反应速率。
③化学反应速率在不同的时间间隔内不一定相等。
④对于没有达到化学平衡状态的可逆反应:v(正)≠v(逆)
13.(1)因体积恒定的容器中,温度与压强均未改变,则反应前后气体体积不变,x+2=2+3,x=3
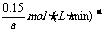
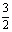 v(A)=
v(A)=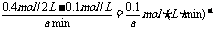
则v(B)= v(A)=
(2)若温度不变,压强变为9/10P,由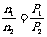
参加反应的n(A)=0.4mol-0.1mol·L-1×2L=0.2mol,
平衡时n(A)=0.4mol-0.2mol=0.2mol
参加反应的n(B)=0.3mol,平衡时n(B)=0.6mol-0.3mol=0.3mol
生成n(C)=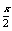 ×0.2mol=0.1x mol,n(D)= 0.2mol
×0.2mol=0.1x mol,n(D)= 0.2mol
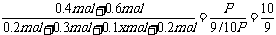
x=2,v(C)=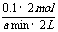 =
=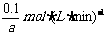
14(1) 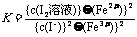 ;向右
;向右
(2) (C) 大于.
15(1)v0=2.73×10-8 mol/(L•s)
(2)当I2消耗一半时,
c(CH3COCH3)=0.1mol/L-1/2×0.01mol/L=0.095mol/L,
c(H+)=0.1mol/L+1/2×0.01mol/L=0.015mol/L,此时的反应速率vt=2.73×10-5×0.095×0.015mol/(L•s)=3.89×10-8 mol/(L•s)显然 vt > v0,所以反应速率比开始时快。
12.A的物质的量浓度 0.75 mol/L
1mol/L <C(B)<1.5 mol/L
讲析:从反应关系看,B物质的量浓度变化值为A的2倍。由图示可知,A物质的量浓度变化值大于0.5mol/L,小于0.75 mol/L,则1mol/L <C(B)<1.5 mol/L。
11.在10℃时反应速率vB为0.3 mol·(L·s)-1,则vA‘为0.1 mol·(L·s)-1, 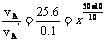 解得x=4。
解得x=4。
10.④>②=③>①
讲析:比较化学反应速率大小的方法:
①由反应速率之比与物质的化学计量数之比,比较后作出判断。②将不同物质表示的速率换算为同一物质表示的速率,再比较速率数值大小。
1.D 2.D 3.C 4.A 5.AB 6.BD 7.C 8.AC 9.CD
讲析:1.化学反应速率通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示。本题中未明确指出容器的容积,故无法判断。 3.压强对反应速率影响的原因仅仅是由于气体压强的改变而引起气体浓度的改变,从而导致速率的改变。C选项涉及的反应中反应物和生成物都没有气体,故选C。 4.答题时不能只考虑混合前两反应物的浓度,否则易误选B。确定反应速率大小的原因是两种反应物的溶液与一定量的水混合后所得溶液中反应物浓度的大小。前者混合溶液中两反应物浓度都为1/25mol·L-1,后者混合溶液中两反应物浓度都为1/30mol·L-1,故ν1>ν2。 5.增加固体接触面积和增大气体压强,可加快正反应速率。C中Fe2O3不是该反应的催化剂,D项中降温可减小速率。故选AB。 6.由图示可知, EF段表示的平均速率最快;EF段,用盐酸表示该反应的平均反应速率为2n(CO2)/(0.1L×1min)= 2×0.02mol/(0.1L×1min)=0.4mol/(L·min);OE、EF、FG三段中,该反应用二氧化碳表示的平均反应速率之比为2:4:1;G点表示收集的CO2的量最多,为784mL。 7.块状CaCO3不如粉状CaCO3反应快,由各自的量决定了最后生成CO2一样多,且反应就此停止。 8.根据同温同体积密闭容器中,压强之比等于物质的量的之比列式求解。准确地解决此类问题,一般需要建模,这样各物质之间量的关系非常明确。 9.催化剂能同等倍数地改变正、逆反应速率,A正确。加压v正、v逆均增大,气体体积之和大的一侧增大倍数大于体积之和小的一侧增加的倍数,B正确。降温v正、v逆均减小,吸热反应减小的倍数大于放热反应减小的倍数,C不正确。加入氩气,如恒温恒容,v正、v逆均不变;如恒温恒压,相当于降压,D不正确。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com