
10.(2010·太原模拟)在下列反应过程中,有3mol电子转移的是( )。
A.lmol钠与水反应
B.27g铝与足量盐酸反应
C.22.4L氧气(标准状况)与足量镁反应
D.1.5mol Na2O2与足量水反应
[解析]选B。先标出每个反应所转移电子数目,然后找出电子数和所给物质之间的关系,即可计算出给定量的物质所转移电子的物质的量。27g铝和标准状况下22.4L氧气的物质的量都是1mol。
|
选项 |
内容指向·联系分析 |
转移电子的物质的量 |
|
A |
2Na+2H2O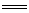 2NaOH+H2↑~2e- 2NaOH+H2↑~2e- |
1mol |
|
B |
2Al+6HCl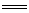 2AlCl3+3H2↑~6e- 2AlCl3+3H2↑~6e- |
3mol |
|
C |
2Mg+O2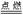 2MgO~4e- 2MgO~4e- |
4mol |
|
D |
2Na2O2+2H2O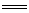 4NaOH+O2↑~2e- 4NaOH+O2↑~2e- |
1.5mol |
9.(2010·郑州模拟)为了确定下列物质是否被氧化,所选试剂(括号内物质)达不到实验目的的是( )。
A.FeCl2溶液(KSCN溶液) B.KI溶液(淀粉溶液)
C.HCHO溶液(紫色石蕊试液) D.K2SO3溶液(BaCl2溶液)
[解析]选D。A项,若FeCl2溶液被氧化,溶液中会有Fe3+生成,加入KSCN溶液后溶液变红色;B项,KI溶液被氧化,溶液中会有I2生成,加入淀粉溶液后溶液变蓝;C项,HCHO溶液被氧化,溶液中会有HCOOH生成,加入紫色石蕊试液溶液变红色;D项,无论K2SO3溶液是否被氧化,加入BaCl2溶液后都有白色沉淀生成。
8.(2010·咸阳模拟)根据S2O82-+2e-→2SO42-、Mn2++4H2O→MnO4-+8H++5e-,推测氧化1.5mol Mn2+需S2O82-的物质的量为( )。
A.1.5mol B.3.75mol C.3.25mol D.3.125mol
[解析]选B。根据氧化还原反应得失电子数相等,可以得如下关系式:5S2O82-~10e-~2Mn2+,所以n(S2O82-)= n(Mn2+)=
n(Mn2+)= ×1.5mol=3.75mol。
×1.5mol=3.75mol。
7.(2010·海口模拟)已知几种阴离子还原性强弱顺序为OH-<Cl-<Br-<I-<S2-。若某溶液含有相同浓度的OH-、Cl-、Br-、I-、S2-,当向其中逐滴加入新制的饱和氯水直至过量时,最后被氧化的离子是( )。
A.Br- B.Cl- C.OH- D.S2-
[解析]选A。因为还原性:S2->I->Br->Cl->OH-,所以Cl2先跟还原性最强的
S2-发生置换反应生成S单质,然后再与I-发生置换反应生成I2单质,最后和Br-发生置换反应生成Br2单质。特别注意Cl2不能将Cl-和OH-氧化,否则会错选C。
6.(2010·上海虹口区模拟)已知NH4CuSO3与足量的2mol/L硫酸溶液混合微热,产生下列现象:①有红色金属生成 ②产生刺激性气味的气体 ③溶液呈现蓝色。据此判断下列说法正确的是( )。
A.反应中硫酸作氧化剂
B.NH4CuSO3中硫元素被氧化
C.1mol NH4CuSO3完全反应转移0.5mol电子
D.刺激性气味的气体是氨气
[解析]选C。红色金属是Cu,蓝色溶液中含Cu2+,NH3和SO2都是有刺激性气味的气体,但是NH3能溶于足量的硫酸溶液,所以该气体一定是SO2,由此可写出该反应的方程式:2NH4CuSO3+2H2SO4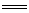 (NH4)2SO4+CuSO4+2SO2↑+Cu↓+2H2O,在该反应中铜元素的化合价由+1价变成0价和+2价,所以NH4CuSO3中铜元素既被氧化又被还原,反应转移1个电子,即1mol NH4CuSO3完全反应转移0.5mol电子。
(NH4)2SO4+CuSO4+2SO2↑+Cu↓+2H2O,在该反应中铜元素的化合价由+1价变成0价和+2价,所以NH4CuSO3中铜元素既被氧化又被还原,反应转移1个电子,即1mol NH4CuSO3完全反应转移0.5mol电子。
5.(2010·通辽模拟)某反应体系的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。下列选项正确的是( )。

A.Na2S4O6、H2O、Na2S2O3、Au2O、NaOH
B.Na2S2O3、NaOH、Na2S4O6、Au2O、H2O
C.Na2S2O3、H2O、Na2S4O6、Au2O、NaOH
D.当1mol Au2O3完全反应时,转移电子的物质的量为8mol
[解析]选C。Au2O3是反应物,则Au2O一定是生成物,其中Au元素化合价由+3价变成+1价,化合价降低,,则必然有化合价升高的,即Na2S2O3(硫元素为+2价)是反应物,Na2S4O6(硫元素为+2.5价)是生成物。根据反应前后硫元素守恒则有:2Na2S2O3→Na2S4O6,根据钠元素守恒,则生成物这边缺少钠元素,所以NaOH是生成物,再根据氢元素守恒,则水是反应物。由关系式:Au2O3~Au2O~4e-,所以当1mol Au2O3完全反应时,转移电子的物质的量为4mol。
4.(2010·南通模拟)科学家发现,食用虾类等水生甲壳类动物的同时服用维生素C容易中毒,这是因为对人体无害的+5价砷类物质在维生素C的作用下,能够转化为有毒的+3价含砷化合物。下列说法中不正确的是( )。
A.维生素C具有还原性
B.上述过程中砷元素发生还原反应
C.上述过程中+5价砷类物质作氧化剂
D.1mol +5价砷完全转化为+3价砷,共失去2mol电子
[解析]选D。由题意知,维生素C能够将+5价的砷变成+3价的砷,所以砷元素发生还原反应,+5价的砷作氧化剂,维生素C发生氧化反应,作还原剂,失去2个电子。
3.(2010·安庆模拟)如图所示,两圆圈相交的阴影部分表示圆圈内物质相互发生的反应,其中属于氧化还原反应,但水既不作氧化剂也不作还原剂的是( )。
A.甲 B.乙 C.丙 D.丁
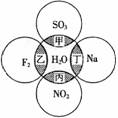
[解析]选C。水中氢元素处于最高价,具有氧化性,氧元素处于最低价,具有还原性,水作还原剂的反应是-2价的氧元素被氧化成O2的反应。水作氧化剂的反应是+1价的氢元素被还原成H2的反应,水既不作氧化剂也不作还原剂的反应是既没有O2产生又没有H2产生的反应。各个反应的方程式及水的作用分析如下表:
|
|
化学方程式 |
是否为氧化还原反应 |
水的作用 |
|
甲 |
SO3+H2O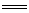 H2SO4 H2SO4 |
不是 |
非氧化剂,非还原剂 |
|
乙 |
2F2+2H2O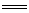 4HF+O2 4HF+O2 |
是 |
还原剂 |
|
丙 |
3NO2+H2O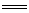 2HNO3+NO 2HNO3+NO |
是 |
非氧化剂,非还原剂 |
|
丁 |
2Na+2H2O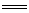 2NaOH+H2↑ 2NaOH+H2↑ |
是 |
氧化剂 |
2.(2010·宿迁模拟)我国“四大发明”在人类发展史上起到了非常重要的作用,其中黑火药的爆炸反应为:2KNO3+S+3C K2S+N2↑+3CO2↑。该反应中被氧化的元素是( )。
K2S+N2↑+3CO2↑。该反应中被氧化的元素是( )。
A.C B.N C.N和S D.N和C
[解析]选A。在该反应中,氮元素由+5价变成0价,硫元素由0价变成-2价,化合价降低,被还原;碳元素由0价变成+4价,化合价升高,被氧化。
1.(2010·商丘模拟)下列物质久置于空气中会发生相应的变化,其中发生了氧化还原反应的是( )。
A.浓硫酸的体积增大 B.铝的表面生成致密的薄膜
C.澄清的石灰水变浑浊 D.氢氧化钠的表面发生潮解
[解析]选B。浓硫酸和氢氧化钠固体都有吸水性,可以吸收空气中的水蒸气而使体积增大或发生潮解,发生物理变化;铝是一种活泼金属,极易被空气中的氧气在表面氧化生成一层致密的氧化物薄膜而具有抗腐蚀性能;澄清的石灰水可以吸收空气中的二氧化碳生成白色的CaCO3沉淀,为非氧化还原反应。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com