
4、复分解型离子反应发生的条件:生成沉淀、气体或难电离的物质(弱酸、弱碱、水等),即向着离子浓度减小的方向进行。
[例题讲解]
例1、 下列物质能导电的是 ,属于电解质的是 ,属于非电解质的是 。
①汞 ②液氨 ③氨水 ④氯化钠晶体 ⑤盐酸 ⑥干冰 ⑦三氧化硫 ⑧金刚石
解析:本题主要考查电解质、非电解质概念和物质的导电情况。若正确回答此题,必须明确:
(1)电解质与非电解质均属于化合物的范围,确定电解质与非电解质时,既要排除单质,又要排除混合物。
(2)导电性不是电解质在任何状况下都有的性质,而是在电解质溶于水或熔化时才具有的性质。
(3)电解质的水溶液或熔化状态下的导电是离子导电,所以电解质必须是自身电离而产生自由移动离子的物质。
答案:能导电的是①、③、⑤;属于电解质的是④;属于非电解质的是②、⑥、⑦。
强调:电解质不一定能导电,能导电的物质不一定是电解质,这一点很容易出现错误。
例2、 下面的离子方程式正确的是( )
A.碳酸钡和稀硫酸
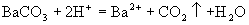
B.
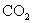 通入足量的
通入足量的
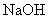 溶液
溶液
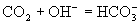
C.向
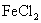 溶液中通入
溶液中通入
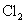 生成
生成
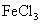
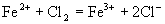
D.澄清石灰水跟盐酸
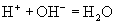
解析:书写离子方程式的基本要求:
①是否符合客观事实。
②化学式与离子符号使用要正确合理。用化学式表示的有气体、沉淀、水、,弱酸、弱碱、氧化物、单质等。用离子符号表示的有易溶于水的强电解质,如强酸、强碱、大多数可溶性盐。
③遵守两个守恒,既质量守恒(两边同种原子个数要相等)和电荷守恒(两 所带电荷数相等)。若是氧化还原反应,还必须遵守得失电子守恒。
选项(A)忽略了生成物 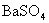 是不溶性物质。正确离子方程式是
是不溶性物质。正确离子方程式是
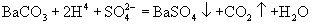
选项(B)因少量的
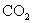 通入足量
通入足量
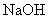 溶液中,
溶液中,
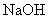 是过量的,正确的离子方程式为
是过量的,正确的离子方程式为
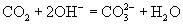
选项(C)虽然表示
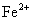 被
被
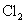 氧化成
氧化成
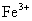 的反应实质,两边各元素的原子个数也相等,但两边的电荷不守恒,得失电子数目不相等。正确的离子方程式应为
的反应实质,两边各元素的原子个数也相等,但两边的电荷不守恒,得失电子数目不相等。正确的离子方程式应为
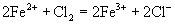
选项(D)正确。澄清石灰水微溶物
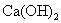 已完全电离,跟盐酸反应的实质是
已完全电离,跟盐酸反应的实质是
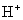 与
与
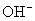 的反应。注意的是石灰乳参加反应则写成化学式
的反应。注意的是石灰乳参加反应则写成化学式
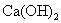 。
。
答案:D
例3 、某无色溶液中加入
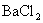 溶液,生成不溶于稀硝酸的白色沉淀,则溶液中溶有的离子是( )
溶液,生成不溶于稀硝酸的白色沉淀,则溶液中溶有的离子是( )
A.一定溶有
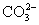 B.一定溶有
B.一定溶有 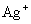
C.一定溶有
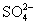 D.可能有
D.可能有 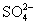 也可能有
也可能有
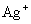
解析:要注意“一定”“可能”含义是不同的。如果是一种离子能满足题意,非此莫属,则溶液中一定会含这种离子。如果符合题意的离子在两种以上,既可以含有该离子,也可能含有另外的符合题意的离子。
本题 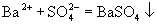 ,
,
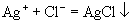 均不溶于
均不溶于
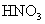 。
。
答案:D
例4、
某河道两旁有甲、乙两厂。它们排放的工业废水中,共含 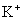 、
、
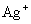 、
、
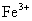 、
、
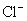 、
、
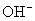 、
、
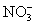 六种离子。
六种离子。
(1)甲厂的废水明显呈碱性,故甲厂废水中含有的三种离子是 、 、 。
(2)乙厂的废水中含有别处三种离子。如果加一定量 (选填:活性炭、硫酸亚铁、铁粉),可以回收其中的金属 (填写金属元素符号)。
(3)另一种设想是将甲厂和乙厂的废水按适当的比例混合,可以使废水中的 (填写离子符号)转化为沉淀。经过滤后的废水主要含 ,可用来浇灌农田。
解析:甲厂排放工业废水明显呈碱性,一定含有
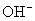 ,与
,与
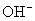 可以共存的离子有
可以共存的离子有
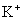 、
、
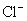 、
、
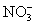 ,考虑到
,考虑到
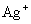 与
与
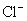 不能共存,所以甲厂废水含
不能共存,所以甲厂废水含
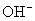 、
、
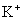 和
和
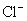 ,乙厂废水中含有
,乙厂废水中含有
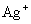 、
、
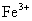 和
和
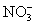 。
。
在乙厂废水中加入一定量的铁粉可以回收银( 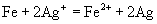 )。
)。
若将两厂废水按适当比例混合,可将 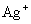 与
与
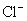 、
、
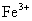 与
与
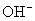 分别转化为
分别转化为
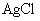 、
、
 沉淀,经过滤后溶液主要含有
沉淀,经过滤后溶液主要含有
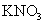 ,
,
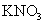 是锌、氮复合肥料。
是锌、氮复合肥料。
答案:(1)
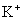 、
、
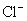 、
、
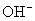
(2)铁粉 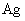
(3)
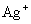 、
、
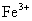 、
、
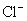 、
、
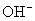 ;
;
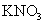
|
课堂小结 |
1、 物质分类的两种方法。 2、分散系、分散质、分散剂、及分类的两种方法。 3、胶体的制法、结构和性质。 4、电解质和非电解质的定义及内涵和外延。 5、书写离子方程式中应记忆的六种气体是一种难电离的物质和66种物质的溶解性。 6、两种书写离子方程式的方法练习。 7、复分解型离子反应发生的条件:生成沉淀、气体或难电离的物质(弱酸、弱碱、水等),即向着离子浓度减小的方向进行。 |
||
|
作业布置 |
整理相关复习内容。 |
||
|
作业反馈 |
|
||
|
教学反思 |
|
||
|
教研组意见 |
|
签名 |
|
西安高级中学课堂教学教案
高 一 年级 5、9、11、12班 学科 化学
|
授课时间 |
2008年10 月 20 日 |
教材版本 |
必
修 |
第一册 |
||||
|
授课人 |
柴荣增 |
|
||||||
|
课 题 |
第二章化学物质及变化归纳与整理 |
课 型 |
复习课 |
第
2 课时 |
||||
|
教学目标 |
知识技能 |
掌握氧化还原反应的六个概念,氧化还原反应的规律。 |
||||||
|
过程与方法 |
培养学生科学抽象、概括整理、归纳总结,准确系统地掌握氧化还原规律的方法。 |
|||||||
|
情感、态度价值观 |
1、举例说明生产、生活中常见的氧化还原反应,关注与化学有关的社会热点问题,逐步形成可持续发展的思想。 2、养成勇于实践、不断创新的科学态度,体会学习科学探究的基本方法。 |
|||||||
|
重点难点 |
氧化还原反应的基本规律(选讲) |
|||||||
|
判断物质氧化性、还原性强弱的一般方法(选讲) |
||||||||
|
课前准备 |
学法 |
从看书、记忆、作业练习、归纳、整理交流、总结掌握氧化还原反应规律。 |
||||||
|
教法 |
通过整理、归纳、探讨、交流、讲练结合,使学生掌握氧化还原反应规律。 |
|||||||
|
实验 |
无 |
|||||||
|
教具 |
多媒体课件 |
|||||||
|
板书设计 教学思路 |
|
|||||||
教学过程
[思考与交流]
例1、在2Al+3H2SO4=Al2(SO4)3+3H2↑的化学反应里,氢元素的化合价由 价降低为 价,降低了 价,氢元素化合价降低的总数为 ,氢离子得到电子总数为 ,则铝元素化合价升高总数为 ,铝原子失去电子总数为 。
例2、在同一个氧化还原反应里,下列说法正确的是 。
A、氧化剂里化合价降低总数与得到电子总数相同
B、还原剂里化合价升高总数与失去电子总数相同
C、氧化剂里化合价降低总数与还原剂里化合价升高总数相等
D、氧化剂里得到电子总数与还原剂里失去电子总数相等。
例3、0.10mol/LH2SO4溶液100mL,最多溶解金属铝的质量为 。
例4、24mL浓度为0.05mL/lNa2SO3溶液恰好与20mL浓度为0.02mol/LK2Cr2O7溶液完全反应转化为Na2SO4。则铬元素在产物中的化合价是 。
[归纳与整理]
3、定一法书写离子方程式。
2、离子方程式的书写步骤(以实验一为例)
①写:写出正确的化学方程式:CuSO4+BaCl2=BaSO4↓+CuCl2
②改:易溶的强电解质改写成离子形式(难溶、难电离的以及气体等仍用化学式表示):Cu2++SO42-+Ba2++2Cl-=BaSO4↓+Cu2++2Cl-
③删:删去两边相同的离子:B a2+ + SO42- = BaSO4↓
④查:检查(质量守恒、电荷守恒)
1、 化学反应分类:
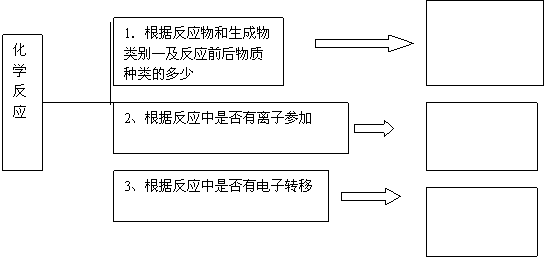
[归纳整理]2 、离子反应
(1)电解质定义
(2)离子反应方程式书写
(3)离子反发生的条件
[投影交流]1、 电解质:在水溶液里或熔融状态下能够导电的化合物。
非电解质:在水溶液或熔融状态下都不导电的化合物。
注意:(1)电解质、非电解质应是化合物。
(2)电解质的导电条件:水溶液里或熔融状态下。
(3)电解质导电必须是用化合物本身能电离出自由移动的离子而导电,不能是发生化学反应生成的物质导电。
(4)某些难溶于水的化合物。它们溶解的部分是完全电离的,是电解质。
(5)酸、碱、盐、水是电解质。
7.关于制备氢氧化铁胶体的正确操作方法
A.在氯化铁溶液中滴入氢氧化钠溶液 B.加热煮沸氯化铁溶液
C.把氯化铁溶液滴入热水中 D.把饱和的氯化铁溶液滴入到沸水中
[交流答案]1、C 2、C 3、A 4、A 5、D 6、BD 7、D
[归纳整理]二、物质的化学变化
6.下列分散系中,能出现丁达尔现象的是
A.蔗糖溶液 B.碘化银胶体 C.浓盐酸 D.豆浆
5.在水泥厂和冶金工厂中,常用高压电对气溶胶作用来除去烟尘,以减少其对空气的污染,这种做法所应用的原理是
A.电解 B.丁达尔现象 C.电加热D.电泳
4.胶体溶液区别盐溶液(一般)的特征是
A.有丁达尔现象 B.电泳 C.加入电解质可形成沉淀 D.透明
3.氯化铁溶液和氢氧化铁胶体共同具有的性质是
A.分散质微粒都能透过滤纸 B.都有丁达尔现象
C.加入盐酸后,都先产生沉淀,然后沉淀又溶解 D.都有电泳现象
2.下列关于胶体的说法中正确的是
A.胶体外观不均匀 B.胶粒不能通过滤纸
C.胶粒做不停的、无秩序的运动D.胶体不稳定,静置后容易产生沉淀
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com