
45.(株洲)化学老师张××指导某化学兴趣学习小组进行了一个有趣的实验探究:测定鸡蛋壳的主要成分碳酸钙的质量分数。实验如下:将鸡蛋壳洗净、干燥并捣碎后,称取8.0g放在烧杯里,然后往烧杯中加入足量的稀盐酸50mL(密度1.1g/ml),充分反应后,称得反应剩余物为59.92g(假设其他物质不与盐酸反应)。请回答:
(1)上述稀盐酸的质量为 g,产生二氧气体的质量为 g。
(2)计算该鸡蛋壳中碳酸钙的质量分数。 (要求写出计算过程)
(3)该稀盐酸中HCI的质量分数应不小于多少?(要求写出计算过程)。
(1)55g,3.08
设:碳酸钙的质量为X,氢化氢的质量为Y
CaCO3+2HCl==CaCl2+H2O+CO2↑
100 73 44
X Y 3.08g
100/44=X/3.08g
X=7g
73/44=Y/3.08g
Y=5.11g
碳酸钙的质量分数为7g/8g=87.5%
盐酸中溶质的质量分数是:5.11g/55g=9.3%
48. 解法一:
解:设10g贝壳中碳酸钙的质量为x.
CaCO3 + 2HCl == CaCl2 + H2O + CO2↑
100 44
X 1.76g
100:X ==44:1.76g 求得X==4g
4g÷10g×100%=40%
答:(略)
解法二:
解:设10g贝壳中碳酸钙的质量为x.
CaCO3 - CO2
100 44
X 1.76g
100:X ==44:1.76g 求得X==4g
4g÷10g×100%==40%
答:(略)
解法三:解:设10g贝壳中碳酸钙的质量分数为x. CaCO3 +2HCl ==CaCl2 +H2O +CO2↑
100 44 10gX 1.76g 100:10gX ==44:1.76g 求得X=40%
答:(略)
解法四: 解:设10g贝壳中碳酸钙的质量为x 碳元素的质量:1.76g×C/CO2×100%==0.48g 根据质量守恒定律可得: xC/CaCO3×100%==0.48g x==48÷12 x=4g 4g÷10g×100%==40% 44.(大连)某补钙剂的主要成分是碳酸钙。为测定该补钙剂中碳酸钙的质量分数,现称取一定质量的样品放在烧杯里,向其中加入稀盐酸至不再产生气泡为止(其他成分不含钙元素,不溶于水也不与稀盐酸反应)。过滤,得到滤渣2.5g,将滤液蒸干,得到氯化钙11.1g。计算:⑴该补钙剂中碳酸钙的质量分数;设补钙剂中碳酸钙的质量为x
CaCO3 +2HCl=CaCl2+H2O+CO2 111/100=11.1/x x=10g 10g/10g+2.5g*100%=80%
⑵某人除正常饮食之外,每天需补充0.64g钙元素,则每天需服用这种补钙剂多少克?
40/100*100%=40% 0.64g/40%/80%=2g
43.(海南)为测定贝壳中碳酸钙的含量,小红将贝壳粉碎后,取样品l0g,与足量的稀盐酸充分反应(杂质不与盐酸反应),产生二氧化碳1.76g。计算贝壳中碳酸钙的质量分数。
42.(南京)一碳化学是以分子中只含一个碳原子的化合物(如CO、CH4等)为原料来合成一系列化工原料和燃料的化学,
(1)工业上用天然气和水蒸气在高温条件下发生反应,得到CO和H2,该反应的化学方程式为 ▲ 得到的CO和H2的混合气被称为合成气,合成气在工业上可用于合成一系列化工原料和新型燃料,还可用于冶炼某些金属。
(2)某他学兴趣小组的同学在实验室模拟了合成气的制备,并设计实验验证合成气的还原性。
I.用甲烷和水蒸气在高温条件下反应得到合成气.根据(1)中所写的化学方程式.合成气中CO和H2的质量比为 ▲ 。
Ⅱ.用合成气还原足量氧化铜.实验装置如下图所示:

[设计买验步骤]
①连接好装置并检查气密性。
②装入药品,通人一段时间合成气。
③分别称量装置D、E的质量。
④缓缓通入合成气,加热装置C,使其充分反应。
⑤停止加热,继续通入合成气至恢复到室温。
⑥再次分别称量装置D、E的质量。
[完善实验设计]经过讨论同学们认为,装置E后还应添加一个酒精灯,并在实验步骤
▲ (填实验步骤的序号)中点燃(点燃前应对气体验纯)。
[进行实验]该小组的同学按上述步骤进行实验,并记录了实验现象和数据:
|
|
装置D的质量 |
装置E的质量 |
|
反应前 |
292.4g |
198.2g |
|
反应后 |
296.0g |
201.5g |
①装置C中出现 ▲ 色物质。
②称量数据如右表所示。
[现象分析和数据处理]
①甲同学根据装置C中的现象,认为是合成气中的CO和H2还原了CuO。 .
②乙同学通过对上表数据的分析,推测除了CO和H2以外,制得的合成气中可能还有未反应的CH4,且CH4也还原了CuO。试通过计算说明他的推测依据。
▲
③丙同学提出,实验步骤⑤中通入的气体会带走装置E中的部分水蒸气,使实验产生误差。你认为该误差对乙同学的推测结果是否有影响?
▲ (选填“是”或“否”,并说明理由)。
[拓展探究]该小组同学对于CH4是否真的能够还原氧化铜提出了质疑并进行探究。
查阅资料:甲烷具有还原性,可以还原氧化铜,生成CO2和H2O;
白色的无水硫酸铜遇水会变成蓝色。
 实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。
实验设计:该小组同学拟用纯净的甲烷气体和如下装置进行实验。

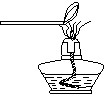
F G I
①上图装置F中盛放的试剂名称是 ▲ 。
②上图装置的正确连接顺序是 ▲ (填字母,且每套装置限用一次)。
[实验反思]除了可能是CH4也还原了CuO外,出现上表数据关系还可能是因为
▲ (写出一个原因,并说明理由)。
▲
(1)CH4+H2O=CO+3H2 (2)I.14:3 Ⅱ.[完善实验设计]② [进行实验]红
[现象分析和数据处理] ②如果只有CO和H。还原足量CuO,合成气中CO与H2的分子个数比为1:3。生成物中碳元素与氢元素的质量比为2;1 如果只有CH4还原足量CuO,生成物中碳元素与氢元索的质量比为3:1 现测得CO2的质量:201.5g--198.2g=3.3g H20的质量:896.0g一292.4g=3.6g
生成物中碳元索与氢元索的质量比:(3·3g×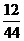 ):(3.6g×
):(3.6g×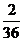 )=9:4
)=9:4
9;4介于2:1和3:1之间,由此可推测出,除了CO和H2以外,制得的合成气中可能还有来反应的CH4,且CH4也还原了CuO。
③否。因为带走水蒸气会使测得的CO2质量偏低·而实际测得的生成物中碳、氢元素的质量比已经大于2 :1,所以对推测结果无影响。(合理叙述均给分)
[拓展探究]澄清石灰水 HGFI
[实验反思]因为根据测得数据计算,生成物中碳、氧元素的质量比太置2:1,所以可能是合成气中参与反应的CO与H2的分子个数比大于1:3(或H2未完全参加反应、
生成的水未被完全吸收等) (合理答案均给分) 。
41.(苏州)下图A-F是实验室制备某些常见气体的装置示意图。
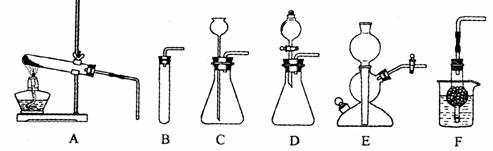
(1)实验室制备CO2的化学方程式为: ▲
可用的发生装置有: ▲ (选填上图字母序号)。
(2)装置E或F相对于装置C在操作方面的优势为: ▲ 。
(3)排水法收集与排空气法收集CO2的比较(分别用体积相同的2个集气瓶收集)
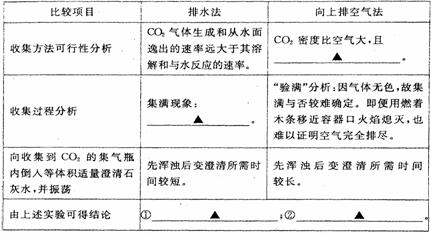
(4)块状石灰石和适量稀盐酸反应至气泡逸出不明显后,测得其残留液pH等于2。此时
取适量反应后溶液,逐滴滴入碳酸钠溶液,并用pH数字探测仪连续监测,得曲线如下
[pH为纵坐标,时间s(秒)为横坐标]:
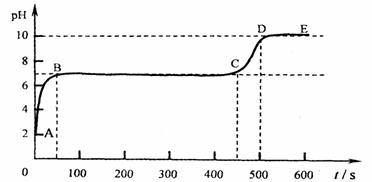
①写出AB段内有关化学方程式 ▲ ,
▲
②写出BC“平台”段化学方程式 ▲ 。
③CD段上升的原因是: ▲ 。

41.(上海)下图是利用CO、CO2混合气体中的CO还原CuO的实验示意图。
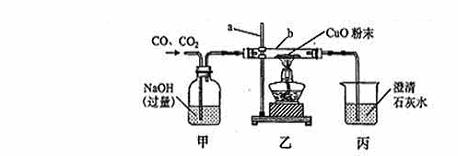
①仪器a的名称是___________。乙装置中应该用酒精灯的_______焰加热。
②写出甲中反应的化学方程式:_____________________________________;
乙装置的仪器b中黑色粉末变红时发生反应的化学方程式:____________。
③反应过程中,丙中可观察到的实验现象是_______________________。
④该装置存在的主要问题是________________________________。
⑤实验结束后,要从甲装置的混合溶液中回收得到较纯净的NaOH固体。
资料显示,在不同温度下NaOH的溶解度如下:
|
温度(℃) |
10 |
20 |
40 |
60 |
80 |
100 |
|
溶解度(g/100g水) |
64 |
85 |
138 |
203 |
285 |
376 |
利用实验室的试剂和条件,实验步骤如下(其中Ⅰ、Ⅱ、Ⅲ为实验操作):
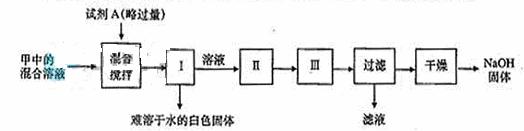
请具体填写试剂A的化学式以及实验操作Ⅰ、Ⅱ、Ⅲ的名称。
化学式:A_____________________;
操作名称:Ⅰ__________________ Ⅱ____________________ Ⅲ__________________。
(1)铁架台 外 (2)方程式略(3)澄清石灰水变浑浊 (4)甲乙装置中间应该再加上澄清石灰水检验CO2是否被吸收完全 (5)Ca(OH)2 过滤 加热(蒸发) 冷却(降温结晶
40.(泰州)下图是一些常见物质的转化关系,其中C是无色无刺激性的气体,且能使澄清石灰水变浑浊;E是一种元污染的清洁能源,其燃烧产物是H。
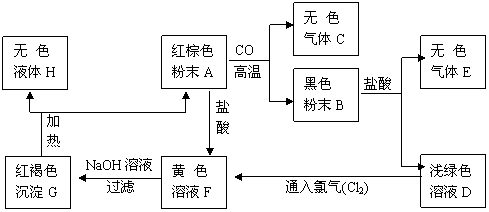

请根据上图,回答下列有关问题:
(1)红棕色粉末A和气体C、E的化学式分别为:A ▲ 、C ▲ 、E: ▲ 。
(2)G转化为H和A的反应类型是 ▲ 反应;B转化成E和D的反应类型是 ▲ 反应。
(3)①A与盐酸反应的化学方程式为: ▲ ;
②D和氯气化合生成F的化学方程式为: ▲ 。
(4)以上图中无色气体C为中心,延展如下图:


①请写出实现这两个转化的另一反应物J、K的化学式:J ▲ 、K ▲ 。
②请完善由CO和CaCO3分别转变成无色气体C的转化关系图,在箭号上注明必要的反应条件和其它反应物。


(1) A:Fe2O3、C: CO2、E:H2 (2) 分解反应 置换反应 (3) ①Fe2O3+6HCl=2FeCl3+3H2O ②2FeCl2+Cl2=2FeCl3 (4) ① C, Ca(OH)2
 ②
②
(由CO或CaCO3转化为CO2的其他合理途径也行)
39.(汕头)2010年4月28日某媒体题为“排污工程施工,毒气放倒三人”的报道,引起
某兴趣小组同学的思考。
[提出问题]排污管道中的毒气有什么成分?
[查阅资料]
I.排污管道中的大部分有机物在一定条件下发酵会产生CO、CO2、H2S、CH4等。
Ⅱ.H2S气体能与CuSO4溶液反应生成黑色沉淀。
[提出猜想]小组同学对排污管道气含有上述气体中最少3种成分的猜想如下:
猜想1:有CO、CO2、H2S; 猜想2:有CO、CO2、CH4;
猜想3:有CO、H2S、CH4; 猜想4:有CO2、H2S、 ;
猜想5:有CO、CO2、H2S、CH4。
[实验方案]小组同学共同设计了下图所示的装置并进行探究(夹持仪器已省略)。
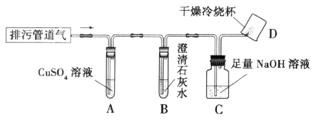
[问题讨论]
(1)如果A装置没有明显变化,则猜想 成立;
如果B装置没有明显变化,则猜想 成立。
(2)在验证猜想l的实验中,装置C中NaOH溶液的作用是 ;若要进一步验证气体燃烧后的产物,操作是:迅速把烧杯倒过来,向烧杯内注入
,振荡。
(3)要确证猜想5中是否有CH4,某同学认为图示装置有不足之处,需要在装置C与D
之间加一个 装置。改进后,若气体燃烧,且D装置内壁出现 ,证明气体中一定含有CH4。
为了进一步确定气体中是否含有CO,可分别测定燃烧产物中H2O、CO2的质
量。其方法是:将燃烧产物依次通过盛有 、 的装置,分别称量吸收燃烧产物前、吸收燃烧产物后装置的质量,通过计算、分析得出结论。
[提出猜想]CH4 [问题讨论] (1) 2 3 (2) 吸收CO2 澄清石灰水
(3) 干燥 水雾 浓H2SO4(或CaCl2或无水CuSO4) NaOH溶液
38.(汕头)请根据所提供的试剂和仪器,按要求填空:
I.试剂:稀硫酸、稀盐酸、过氧化氢溶液、大理石、二氧化锰
Ⅱ.仪器:(铁架台、石棉网等已省略)
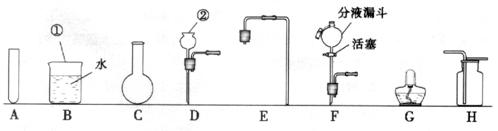 (1)写出图中标有①、②仪器的名称:①
,②
。
(1)写出图中标有①、②仪器的名称:①
,②
。
(2)实验室制取氧气时,为了便于控制反应且获得平稳的气流,发生装置可选用图中的
(填字母),化学方程式为 。
用该装置和提供的试剂还可以制取 气体,化学方程式为
。
收集方法是 ,检验该气体满瓶的方法是
。
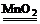 (3)设计一套制取少量蒸馏水的简易装置,需选择图中的A、B和
(填字母)。
(3)设计一套制取少量蒸馏水的简易装置,需选择图中的A、B和
(填字母)。
(1) 烧杯 长颈漏斗 (2) C、F或A、F 2H2O2 2H2 O+ O2↑ CO2
CaCO3+2HCl === CaCl2+H2O+CO2↑ 向上排空气法 将燃着的木条放在瓶口,火焰熄灭,证明满瓶 (3) C、E、G
37.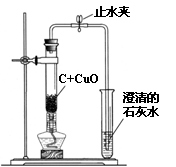 (梧州)某中学化学兴趣小组按照课本实验方法(如图19甲),做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。他们决定对这个实验进行探究和改进。
(梧州)某中学化学兴趣小组按照课本实验方法(如图19甲),做木炭与氧化铜反应实验时,发现很难观察到紫红色铜的生成,却往往有暗红色固体出现。他们决定对这个实验进行探究和改进。
|
|||
|
|
|
|
[提出问题]暗红色的固体是什么?如何选择合适的条件,使木炭还原氧化铜的实验现象更明显?
[查阅资料]铜有+1和+2两种化合价,通常情况下,氧的化合价为-2,碳的化合价为+4或-4。
[猜想与假设]
(1)同学们认为这种暗红色固体可能是一种化合物,并猜测它的化学式为 。
(2)同学们还认为,通过改变反应物的状态、质量比,以及反应装置,可以使该实验现象更加明显,减少出现暗红色固体的情况。
[分析与交流]
(1)小吴建议用超细炭粉与氧化铜粉末进行实验。你认为这样建议的原理是 。
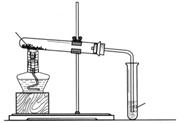
(2)小周建议用图19的乙装置替代甲装置。与甲相比较,乙装置中将试管直立放
置的作用是 。
(3)对下列三种氧化铜和碳的质量比例,小施建议选择 (填选项序号)的比例。
A. 32︰3 B. 40︰3 C. 48︰3
你认为小施这样选择的理由是 。
[实验与结论]
同学们决定按改进后的方案进行实验,他们在检验了乙装置的 后,往试管中加入已干燥的药品并开始加热,当看到澄清的石灰水刚出现浑浊时, (填“可以”或“不能”)确定氧化铜和炭粉已经开始反应。
不久,即可看到试管底部变红热,停止加热后,仍能看到红热现象,并沿试管底部自下而上蔓延,这个现象说明该反应是 (填“吸”或“放”)热反应。
待反应结束,先将导气管从石灰水中取出,然后关闭止水夹,让产物自然冷却。若不关闭止水夹,可能出现的问题是 。
待产物冷却后,同学们终于找到了期待已久的紫红色铜珠,实验获得了圆满成功。
[猜想与假设]Cu2O (Cu4C、Cu2C等其他合理答案同样给分)
[分析与交流](1)这是固体反应物间的反应,使用颗粒更小的反应物,可以增加表面积,有利于反应的进行。(2)有利于集中加热,获得持续高温。(3) A 反应中炭粉会与试管内的氧气反应而部分消耗,故稍过量的炭粉有利于反应的进行。
[实验与结论]气密性 不能 放 空气会进入反应的试管中,使生成的依然灼热的铜重新被氧化。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com