
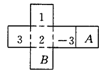
3.如图3是一正方体纸盒的展开图,在其中的四个正方形内标有数字1,2,3和-3,要在其余正方 形内分别填上-1,-2,使得按虚线折成正方体后,相对面上的两数互为相反数,则A处应填( ).
形内分别填上-1,-2,使得按虚线折成正方体后,相对面上的两数互为相反数,则A处应填( ).
A.-2 B.-3 C.1 D. 3
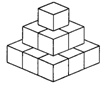
2.一个画家有14个边长为1米的正方体,他在地面上把它们摆成如图2所示的形式,然后他把露出的表面都涂上颜色,那么被涂上颜色的总面积为( ).
A.19平方米 B.21平方米 C.33平方米 D.34平方米
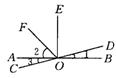
1.如图1,直线AB,CD相交于点O,OE⊥AB于点O,OF平分∠AOE,∠1=15°30′,则下列结论中不正确的是( ).
A.∠2=45° B.∠1=∠3
C.∠AOD与∠1互为补角 D.∠1的余角等于75°30′
(1) (2) (3) (4)
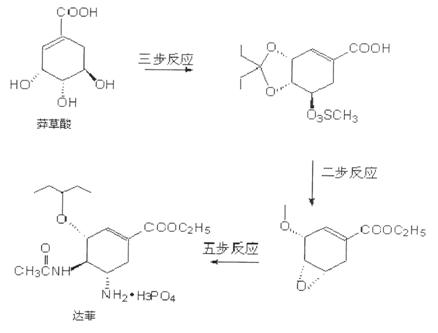
37.[化学--选修有机化学基础](15分)
目前世界上已证明“达菲”Tamiflu是治疗禽流感和甲型H1N1流感的一个良方。达菲是以从八角提取的莽草酸为原料,再经过十几步反应得的
36.[化学-选修物质结构与性质](15分)
下面的表格是元素周期表的一部分,其中的字母对应不同的元素。(用元素符号回答问题)
|
A |
|
|
|||||||||||||||
|
|
|
|
|
M |
Q |
R |
|
|
|||||||||
|
|
|
E |
|
B |
|
D |
|
||||||||||
|
|
|
|
G |
|
|
|
|
|
|
L |
|
|
|
C |
|
|
|
请回答下列问题:
(1)M、Q、R按第一电离能由小到大的顺序为 。
(2)Q元素的氢化物分子的立体结构呈 形,该分子属于 分子(填“极性”或“非极性”),中心原子呈 杂化方式;
(3)写出L基态原子核外电子排布式 ,L的硫酸盐溶液中加入过量Q的氢化物的水溶液可得深蓝色溶液,请写出该溶液显深蓝色的微粒的化学式 。
(4)已知AMQ分子是直线型分子,则其分子中含有σ键和π键的数目之比为 。
(5)试比较Q、B和C的氢化物沸点高低及热稳定性并说明理由 。
28.(14分)㈠下列物质属于非电解质的是 ,属于弱电解质的是
①氨水 ②SO2 ③CI2 ④甲酸 ⑤BaSO4 ⑥CH3OH ⑦H2O ⑧NaHCO3 ⑨AI2O3
㈡有A、B、C、D、E和F六瓶无色溶液,他们都是中学化学中常用的无机试剂。纯E为无色油状液体;B、C、D和F是盐溶液,且他们的阴离子均不同。现进行如下实验:
①A有刺激性气味,用沾有浓盐酸的玻璃棒接近A时产生白色烟雾;
②将A分别加入其它五种溶液中,只有D、F中有沉淀产生;继续加入过量A时,D中沉淀无变化,F中沉淀完全溶解;
③将B分别加入C、D、E、F中,C、D、F中产生沉淀,E中有无色、无味气体逸出;
④将C分别加入D、E、F中,均有沉淀生成,再加入稀HNO3,沉淀均不溶。
根据上述实验信息,请回答下列问题:
⑴ 能确定的溶液是(写出溶液标号与相应溶质的化学式):
⑵ 不能确定的溶液,写出其标号、溶质可能的化学式及进一步鉴别的方法:
13. 通常人们把拆开1 mol某化学键所吸收的能量看成该化学键的键能。键能的大小可用于估算化学反应的焓变(ΔH),化学反应的ΔH等于反应中断裂旧化学键的键能之和与反应中形成新化学键的键能之和的差。
|
化学键 |
H---H |
Cl---Cl |
H---Cl |
|
生成1 mol化学键时所放出的能量(kJ·mol-1) |
436 |
243 |
431 |
则下列热化学方程式不正确的是( )
A.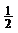 H2(g)+
H2(g)+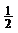 Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1
Cl2(g)=HCl (g) ΔH= ﹣91.5 kJ·mol-1
B. H2(g)+ Cl2(g)=2HCl (g) ΔH= ﹣183kJ·mol-1
C.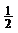 H2(g)+
H2(g)+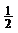 Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1
Cl2(g)=HCl (g) ΔH= ﹢91.5 kJ·mol-1
D.2HCl(g) =H2(g)+ Cl2(g) ΔH= ﹢183kJ·mol-1
12. 下列反应的离子方程式正确的是( )
A.碳酸钠溶液显碱性: CO32-+2H2O H2CO3+2OH -
H2CO3+2OH -
B.碳酸氢钠溶液中加入过量石灰水:HCO3-+ OH-= CO32-+ H2O
C.用小苏打治疗胃酸过多: HCO3-+H+=CO2↑+H2O
D.向苯酚钠溶液中通入少量二氧化碳:CO2 + H2O + 2C6H5O- → 2C6H5OH + CO32--
11. 在一体积可变的密闭容器里,加入一定量的M、N,发生反应aM(g)+bN(g) cP(g),△H =Q kJ·mol-1,反应达平衡时,P的物质的量浓度(mol·L-1)与容器体积和温度的关系如下表,其中,说法正确的是( )
cP(g),△H =Q kJ·mol-1,反应达平衡时,P的物质的量浓度(mol·L-1)与容器体积和温度的关系如下表,其中,说法正确的是( )
  c(P) c(P)
|
1 L |
2 L |
3 L |
||||
|
100℃ |
1.30 |
1.00 |
0.70 |
||||
|
200℃ |
1.20 |
0.90 |
0.62 |
||||
|
300℃ |
1.00 |
0.75 |
0.53 |
A.Q>0
B.温度不变,扩大容器体积,正反应速率增大,逆反应速率减小
C.容器体积不变,升高温度,平衡体系中M的体积百分含量减小
D. a+b<c
10. 一定条件下,体积为10L的密闭容器中,1molX和1molY进行反应:
2X(g)+Y(g)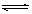 Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
Z(g),经60s达到平衡,生成0.3molZ。下列说法正确的是( )
A.以X浓度变化表示的反应速率为0.001mol/(L·S)
B.将容器体积变为20L,Z的平衡浓度变为原来的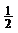
C.若增大压强,则物质Y的转化率减小
D.若升高温度,X的体积分数增大,则该反应的△H>0
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com