
|
|
同周期(从左到右) |
同主族(从上到下) |
|
最外层电子数 |
由1→8 |
相同 |
|
特征电子排布 |
从ns1→ns2 np6 |
相同(ns1-2或ns2np1-6) |
周期、族与电子层构型
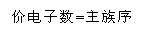
 S区元素价电子特征排布为nS1~2
S区元素价电子特征排布为nS1~2
p区元素特征电子排布为ns2np1~6
d区元素价电子排布特征为(n-1)d1~10ns1~2;最高能级组中的电子总数=族数
ds区元素特征电子排布为(n-1)d10ns1~2; 最外层电子数=族数
3.光谱:不同元素的原子发生跃迁时会吸收(基态→激发态)和放出(基态→激发态)能量,产生不同的光谱--原子光谱(吸收光谱和发射光谱)。利用光谱分析可以发现新元素或利用特征谱线鉴定元素。
2.激发态:较高能量状态(相对基态而言)。如基态原子的电子吸收能量后,电子跃迁至较高能级成为激发态原子。
1.基态:最低能量状态。如处于最低能量状态的原子称为基态原子。
4.洪特规则:电子排布在同一能级的各个轨道时,优先占据 轨道,且自旋方向 。
3.泡利不相容原理:每个原子轨道里最多只能容纳 个自旋方向 的电子。
2.能量最低原理:能量最低原理:原子核外电子遵循构造原理排布时,原子的能量处于最低状态。即在基态原子里,电子优先排布在 的能级里,然后排布在能量逐渐升高的能级里。当某能级中的原子轨道处于全充满或半充满状态时能量较低。
1.构造原理:绝大多数基态原子核外电子的排布都遵循下列顺序:
1s、2s、2p、3s、3p、 、 、4p、5s、4d、5p、6s、4f……
构造原理揭示了原子核外电子的能级分布。从中可以看出,不同能层的能级有交错现象,如E(3d)>E(4s)、E(4d)>E(5s)、E(5d)>E(6s)、E(6d)>E(7s)、E(4f)>E(5p)、E(4f)>E(6s)等。
构造原理是书写基态原子电子排布式的依据,也是绘制基态原子电子排布图(即轨道表示式)的主要依据之一。
2.原子轨道:不同能级上的电子出现概率约为90%的电子云空间轮廓图。s电子的原子轨道呈 对称, ns能级各有 个原子轨道;p电子的原子轨道呈 ,np能级各有 个原子轨道,相互垂直(用px、py、pz表示);nd能级各有 个原子轨道;nf能级各有 个原子轨道。各轨道的的形状与所处的能层无关。
1.电子云:电子在原子核外出现的概率密度分布。电子云是核外电子运动状态的形象化描述,小黑点的疏密表示 。
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com