
15.有BaCl2和NaCl的混合溶液a L,将它均分成两份.一份滴加稀硫酸,使Ba2+完全沉淀;另一份滴加AgNO3溶液,使Cl-完全沉淀.反应中消耗x mol H2SO4、y mol AgNO3.据此得知原混合溶液中的c(Na+)(mol/L)为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
14.常温下,在密闭容器里分别充入两种气体各0.1 mol,在一定条件下充分反应后,恢复到原温度时,压强降低为开始时的1/4.则原混合气体可能是( )
A.H2和O2 B.HCl和NH3 C.H2和Cl2 D.CO和O2
13.下列离子方程式与所述事实相符且正确的是( )
A.漂白粉溶液在空气中失效:ClO-+CO2+H2O===HClO+HCO
B.用浓盐酸与MnO2反应制取少量氯气:MnO2+2H++2Cl-Mn2++Cl2↑+2H2O
C.向NaAlO2溶液中通入过量CO2制Al(OH)3:
AlO+CO2+2H2O===Al(OH)3↓+HCO
D.在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:
3ClO-+2Fe(OH)3===2FeO+3Cl-+H2O+4H+
12.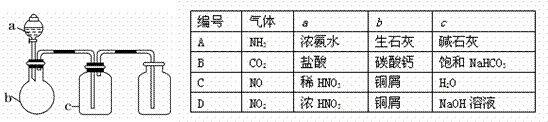 下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是( )
下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是( )
11.下列说法正确的是( )
A.要氧化除去FeCl2溶液中含有I-杂质,可加入的试剂是FeCl3
B.已知:常温时,下列三个反应都能自发的向右进行:2W-+X2===2X-+W2
2Y-+W2===2W-+Y2 2X-+Z2===2Z-+X2,则反应2Z-+Y2===2Y-+Z2
也能自发向右进行
C.NO2―→NO必须加入还原剂才能实现
D.在一定条件下,分别以高锰酸钾、氯酸钾、H2O2为原料制取氧气,当制得同温、
同压下相同体积的氧气时,三个反应中转移的电子数之比为1∶1∶1
10.下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②将0.1 mol/L的NaOH溶液与0.5 mol/L的CuSO4溶液等体积混合制得氢氧化铜浊液,用于检验醛基
③实验室制硝基苯要把温度计插在烧杯热水的中部
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球上缘与蒸馏烧瓶支管口下缘相平
A.①④ B.③④⑥⑦ C.①③ D.②④⑤
9.在两个密闭容器中,分别充有质量相同的甲、乙两种气体,若两容器的温度和压强均相同,且甲的密度大于乙的密度,则下列说法正确的是( )
A.甲的分子数比乙的分子数多
B.甲的物质的量比乙的物质的量少
C.甲的摩尔体积比乙的摩尔体积小
D.甲的相对分子质量比乙的相对分子质量小[
8.在浓盐酸中H3AsO3与SnCl2反应的离子方程式为:SnCl2+Cl-+H3AsO3+H+--As+SnCl+M(未配平),关于该反应的说法中正确的组合是( )
①氧化剂是H3AsO3 ②还原性:Cl->As ③每生成0.1 mol的As,还原剂失去的电子为0.3 mol ④M为OH- ⑤SnCl是氧化产物 ⑥H+前面的配平系数为6
A.①③⑤⑥ B.①②④⑤ C.①②③④ D.只有①③⑥
7.在含有碳酸根离子,且能使酚酞变红的无色溶液中,能大量共存的离子组是( )
A.Na+、SO、SO、K+ B.Na+、Cu2+、Br-、Ba2+
C.K+、MnO、NO、Na+ D.K+、Ca2+、SO、Cl-
6.用下图装置测定水中氢、氧元素的质量比,其方法是分别测定通氢气前后玻璃管的质量差和U形管的质量差.李松同学通过实验得出的结论是m(H)∶m(O)>1∶8.下列对导致这一结果原因的分析中,一定不合理的是( )
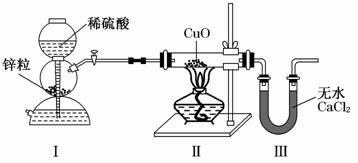
A.Ⅰ、Ⅱ装置之间缺少干燥装置
B.Ⅲ装置后缺少干燥装置
C.Ⅱ装置中的CuO粉末可能不干燥
D.CuO没有全部被还原
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com