
6.用数学归纳法证明一个与正整数有关的命题的步骤:
(1)证明:当n取第一个值n0结论正确;
(2)假设当n=k(k∈N*,且k≥n0)时结论正确,证明当n=k+1时结论也正确.
由(1),(2)可知,命题对于从n0开始的所有正整数n都正确 
5. 数学归纳法的基本思想:即先验证使结论有意义的最小的正整数n0,如果当n=n0时,命题成立,再假设当n=k(k≥n0,k∈N*)时,命题成立.(这时命题是否成立不是确定的),根据这个假设,如能推出当n=k+1时,命题也成立,那么就可以递推出对所有不小于n0的正整数n0+1,n0+2,…,命题都成立.
4.数学归纳法:对于某些与自然数n有关的命题常常采用下面的方法来证明它的正确性:先证明当n取第一个值n0时命题成立;然后假设当n=k(kÎN*,k≥n0)时命题成立,证明当n=k+1时命题也成立 这种证明方法就叫做数学归纳法
这种证明方法就叫做数学归纳法
3. 完全归纳法: 把研究对象一一都考查到了而推出结论的归纳法称为完全归纳法.
完全归纳法是一种在研究了事物的所有(有限种)特殊情况后得出一般结论的推理方法,又叫做枚举法.与不完全归纳法不同,用完全归纳法得出的结论是可靠的.通常在事物包括的特殊情况数不多时,采用完全归纳法.
2. 不完全归纳法: 根据事物的部分(而不是全部)特例得出一般结论的推理方法叫做不完全归纳法.
1. 归纳法:由一些特殊事例推出一般结论的推理方法.特点:特殊→一般
20.(2010·上海静安区模拟)可以通过实验探究有关物质氧化性和还原性的强弱。
Ⅰ.探究有关物质氧化性的强弱。
已知Bi位于周期表中VA族,+3价较稳定,NaBiO3溶液为无色,Bi3+无色;Mn2+无色,MnO4-呈紫红色;Pb位于周期表中IVA族,+2价较稳定,PbSO4是一种白色沉淀。取一定量的Mn(NO3)2溶液依次进行实验,现象记录如下。
①滴加适量的NaBiO3溶液,溶液变为紫红色。
②继续滴加适量H2O2,紫红色褪去,并有气泡产生。
③再加入适量的PbO2固体,固体溶解,溶液又变为紫红色。
④最后通入足量的SO2气体。
请回答下列问题:
(1)推测实验④中的现象为____________________________。
(2)分析上述现象,KMnO4、H2O2、PbO2氧化性由强到弱的顺序为________。
Ⅱ.探究镁、铝、铜金属单质还原性的强弱。
现有镁条、铝片、铝粉、铜片、氧化镁、氧化铝、氧化铁、盐酸、硝酸银溶液、硫酸铜溶液及其它常用的实验用品和仪器,根据现有药品,请你设计简单实验验证镁、铝、铜金属单质的还原性强弱。
依据你设计的实验方案,回答下列问题:
(3)实验原理:用化学方程式表示实验中的反应:
①________________________________________;
②________________________________________;
③________________________________________。
(4)实验现象:能够充分说明镁、铝、铜金属单质还原性强弱的明显现象是________。
[解析]Ⅰ.①向Mn(NO3)2溶液中滴加NaBiO3溶液时,溶液变为紫红色,说明有MnO4-生成,即Mn2+被氧化成MnO4-,NaBiO3溶液被还原成Bi3+,所以氧化性NaBiO3>KMnO4;②向所得到的KMnO4溶液中滴加H2O2,紫红色褪去,说明MnO4-被还原成Mn2+,H2O2被氧化成O2,所以氧化性KMnO4>H2O2;③向含Mn2+的溶液中加入PbO2固体,固体溶解,溶液又变为紫红色,说明Mn2+又被氧化成MnO4-,PbO2被还原成Pb2+,所以氧化性PbO2>KMnO4;④MnO4-可以将SO2氧化成SO42-,SO42-和Pb2+结合生成白色的PbSO4沉淀。
Ⅱ.镁、铝是活泼金属,能够和盐酸反应放出氢气,但是更活泼的镁反应更为剧烈;铜是不活泼金属,不能和盐酸反应放出氢气,但是可以和硝酸银溶液发生置换反应生成更不活泼的单质银。
[答案]
(1)紫红色褪去,生成白色沉淀
(2)PbO2>KMnO4>H2O2
(3)Mg+2HCl=MgCl2+H2↑ 2 Al+6HCl=2AlCl3+3H2↑
Cu+2AgNO3=Cu(NO3)2+2Ag
(4)镁条、铝片分别与盐酸反应时,镁条与盐酸反应更剧烈;铜和硝酸银溶液反应时,铜片表面有银白色物质析出。
()
19.(2010·上海浦东区模拟)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一氧化还原反应的体系中,反应物和生成物共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
(1)该反应中,化合价升高的反应物是____________,化合价没有发生变化的反应物是________________。
(2)写出一个包含上述七种物质的氧化还原反应方程式(需配平):
________________________________________________________________。
(3)上述反应中,1mol氧化剂在反应中_______(填“得到”或“失去”)____mol电子。
(4)如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:_________________________________________。
[解析]根据题给信息KMnO4和盐酸反应生成氯气,而所给物质中KCl中含有Cl-,H2SO4中含有H+,所以反应物是KMnO4、KCl和H2SO4,生成物是K2SO4、MnSO4、Cl2和H2O。锰元素化合价由+7价变成+2价,化合价降低,被还原;氯元素的化合价由-1价变成0价,化合价升高,被氧化,根据化合价升降数相等可得如下配平的化学方程式:2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O。在反应后的溶液中加入NaBiO3,溶液又变紫红色,说明有MnO4-生成,即BiO3-将Mn2+氧化成MnO4-,所以NaBiO3具有强氧化性,其氧化性比KMnO4氧化性强。
[答案](1)KCl;H2SO4
(2)2KMnO4+10KCl+8H2SO4=6K2SO4+2MnSO4+5Cl2↑+8H2O
(3)得到;5
(4)NaBiO3具有强氧化性(比KMnO4氧化性强)
18.(2010·苏州模拟)一个完整的氧化还原反应方程式可以拆开,写成两个“半反应式”,一个是“氧化反应式”,一个是“还原反应式”。如2Fe3++Cu=2Fe2++Cu2+,可拆写为氧化反应式:Cu-2e-=Cu2+,还原反应式:2Fe3++2e-=2Fe2+。据此,回答下列问题:
(1)将反应Zn+2H+=Zn2++H2↑拆写为两个“半反应式”:
氧化反应式:__________________,还原反应式:__________________。
(2)将反应3NO2+H2O=2H++2NO3-+NO拆写为两个“半反应式”:
氧化反应式:__________________,还原反应式:__________________。
(3)已知某反应的两个“半反应式”为:CH4+10OH--8e-=CO32-+7H2O,O2+2H2O+4e-=4OH-,则氧化还原反应方程式为__________________。
[解析](2)注意电子得失守恒、原子数目守恒以及物质的选择与化学计量数调整。在反应3NO2+H2O=2H++2NO3-+NO中,只有1个NO2分子作氧化剂,有2个NO2分子作还原剂。2个NO2分子变为2个NO3-离子时,需2个H2O分子提供2个O原子,2个H2O分子中的4个H原子则变为4个H+离子。1个NO2分子变成1个NO分子时,另1个O原子需要与2个H+结合生成水。(3)前式+后式×2即得。
[答案](1)Zn-2e-=Zn2+,2H++2e-=H2↑
(2)2NO2+2H2O-2e-=4H++2 NO3-;NO2+2 H++2e-=NO+H2O
(3)CH4+2O2+2OH-=CO32-+3H2O
17.(2010·云南师大附中模拟)煤炭中以FeS2形式存在的硫,在有水和空气及在脱硫微生物存在下发生生物氧化还原反应,有关反应的离子方程式依次为:
①2FeS2+7O2+2H2O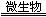 4H++2Fe2++____________;
4H++2Fe2++____________;
②4Fe2++O2+4H+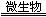 4Fe3++____________;
4Fe3++____________;
③FeS2+2Fe3+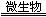 3Fe2++2S;
3Fe2++2S;
④2S+3O2+2H2O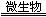 4H++2SO42-。
4H++2SO42-。
已知:FeS2中的硫元素为-1价。
回答下列问题:
(1)根据质量守恒定律和电荷守恒定律,将上述①②离子方程式补充完整。
(2)反应③的还原剂是__________________。
(3)观察上述反应,FeS2最终转化为____________从煤炭中分离出来
[解析](1)根据电荷守恒定律,反应①左边没有电荷,右边已有8个正电荷,还缺8个负电荷,结合质量守恒定律,反应物中还含有4个S和16个O,其个数比为1∶4,所以缺少4个SO42-。(2)根据电荷守恒定律,反应②左边有12个正电荷,右边已有12个正电荷,所以缺少一种电中性物质,结合质量守恒定律,反应物中还含有4个H和2个O,其个数比为2∶1,所以缺少2个H2O。(3)从上述四个反应可以看出,硫元素的变化过程为:FeS2→SO42-,FeS2→S→SO42-,所以硫元素最终变成SO42-;铁元素的变化过程为:FeS2→Fe2+→Fe3+→Fe2+,所以铁元素最终变成Fe2+;
[答案](1)①4SO42- ②2H2O(漏掉或写错系数每处扣1分)
(2)FeS2
(3)Fe2+和SO42-或FeSO4和H2SO4
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com