
7、.联合制碱法中关键的一步是把NH4Cl从几乎饱和的NaHCO3溶液中分离出来,为此根据NaCl和NH4Cl溶解度的差异,向混合溶液中通入某种气体,同时加入磨细的食盐,可析出不夹带NaHCO3的NH4Cl。NaCl和NH4Cl共同存在时的溶解度曲线如图所示,以下操作正确的是 ( )
|
|
通入气体 |
温度控制 |
|
(A) (B) (C) (D) |
CO2 CO2 NH3 NH3 |
30~40℃ 0~10 ℃ 30~40 ℃ 0~10℃ |
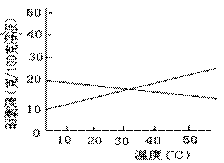
6、实验室加热酒精、醋酸和浓硫酸的混合液蒸馏出乙酸乙酯,为什么用饱和碳酸钠溶液接收馏出液的理由,你认为正确的是 ( )
① 吸收未反应完的醋酸 ② 溶解未反应完的酒精 ③ 降低乙酸乙酯在水中的溶解度 ④ 增大接收液的密度,便于后续的分液(得乙酸乙酯)操作 ⑤ 不能用NaHCO3饱和溶液来代替Na2CO3饱和溶液的原因是因为NaHCO3在水中的溶解度远比Na2CO3小 ⑥ 不能用饱和食盐水代替饱和碳酸钠溶液的原因是它不能吸收未反应完的醋酸
A. ①②⑤⑥ B. ①②③④ C. ②④⑤ D. ①②③④⑤⑥
5.下列分离或提纯物质的方法正确的是 ( )
A.用过滤的方法精制氢氧化铁胶体
B.用加热的方法提纯含有少量碳酸氢钠的碳酸钠
C.用溶解、过滤的方法提纯含有少量硫酸钡的碳酸钡
D.用盐析的方法分离、提纯蛋白质
4.下列实验操作中,错误的是 ( )
A. 配制5%食盐溶液时,将称量的食盐放入烧杯中加计量的水搅拌溶解
B. 铜结晶水含量测定时,需用小火缓慢加热,防止晶体飞溅
C. 测定未知NaOH溶液浓度时,碱式滴定管需用标准液润洗2-3次
D. 配制0.1 mol / L的H2SO4溶液时,将量取的浓H2SO4放入容量瓶中加水稀释
3.(选考内容)在一定条件下,萘可以被硝硫混酸硝化生成二硝基化合物,它是1,5-二硝基萘和1,8-二硝基萘的混合物。 ( )
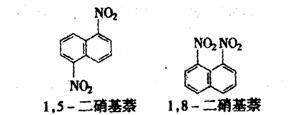
后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一性质可以将这两种异构体分离。
将上述硝化产物加入适量的98%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8-二硝基萘,应采用的方法是 ( )
A.蒸发浓缩结晶 B.向滤液中加水后过滤
C.用Na2CO3溶液处理滤液 D.将滤液缓缓加入水中
2.现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是 ( )
A. 分液、萃取、蒸馏 B. 萃取、蒸馏、分液
C.分液、蒸馏、萃取 D. 蒸馏、萃取、分液
1.以下实验装置一般不用于分离物质的是 ( )
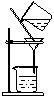
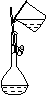
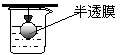
A B C D
1.物质的分离与提纯中的基本操作
|
操作名称 |
适用范围和实例 |
装置 |
操作要点 |
|
过滤(沉淀洗涤) |
固体(不溶)--液体分离
例:除去粗盐中的泥沙 |
 |
(1)滤纸紧贴漏斗壁,用水润湿不出气泡为止,滤纸边缘低于漏斗口上沿;玻璃棒顶在三层滤纸处;过滤时加入漏斗的溶液面低于滤纸边缘,即“一贴两低三靠”
。
⑵过滤时:烧杯嘴与玻璃棒接触,漏斗嘴紧靠烧杯内壁;
⑶加水,水面高于沉淀,浸洗三次,达到净化沉淀。 |
|
蒸发结晶(重结晶) |
固体-液体分离,例:食盐溶液的蒸发结晶
利用物质在同一溶剂中溶解度不同,进行固体-固体(均溶)分离。例:KNO3、NaCl的结晶分离。 |
 |
(1)蒸发皿可直接接受热。固定在铁架台的铁环上。
(2)加热时用玻璃棒不断地搅动防止热液溅出,发现溶液出现较多固体或快干时撤火。利用余热将溶液蒸干。 |
|
蒸馏分馏 |
分离沸点不同的液体混合物,例:从石油中分馏出各馏分。从乙醇、乙酸、浓H2SO4混和液中蒸馏出乙酸乙酯 |
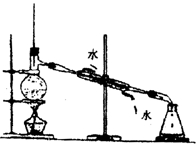 |
(1)蒸馏烧瓶加热要垫石棉网,温度计水银球放在支管口附近。
(2)冷凝管横放时头高尾低保证冷凝液自然下流,冷却水与被冷凝蒸气流向相反
(3)烧瓶中放入瓷片以防爆沸 |
|
萃取分液 |
将两种互不相深的液体分开。例:用CCl4将碘从碘水中萃取出来后,再分液分离 |
 |
(1)将溶液注入分液漏斗中,溶液总量不超过其容积的3/4,如图所示,两手握住分液漏斗、倒转分液漏斗并反复、用力振荡
(2)把分液漏斗放在铁架台的铁圈中静置、分层
(3)打开旋塞,使下层液体流出 |
|
洗气 |
气-气分离(杂质气体与试剂溶解或反应)例:用饱和食盐水除去Cl2气中HCl杂质,用Br2水除CH4中的C2H2 |
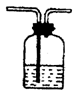 |
混和气体通入洗气瓶 |
|
渗析 |
胶粒与溶液中的溶质分离。例:用渗析的方法除去淀粉胶体中的NaCl |
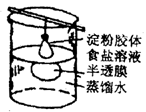 |
将要提纯的胶体装入半透膜中,将半透膜袋系好,浸入蒸馏水中,渗析的时间要充分 |
|
加热 |
杂质发生反应。例:Na2CO3中含有NaHCO3杂质,MnO2中混有炭粉杂质可用加热法除去 |
 |
用玻璃棒搅拌,使受热均匀 |
|
升华 |
分离不升华与易升华的物质。例:磺、萘的提纯 |
 |
|
|
盐析 |
胶体从混合物中分离出来。例:硬脂酸钠溶液中加入食盐细粒;鸡蛋白溶液中加入饱和(NH4)2SO4溶液 |
|
|
|
离子交换 |
将溶液中的离子与液体分离。例:软化硬水 |
|
|
[过关训练]
7]范琳,王庆华.英语词汇学习中的分类组织策略实验研究[J]外语教学与研究,2002,(03).
6]王文宇.观念、策略与英语词汇记忆[J]外语教学与研究,1998,(01).
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com