
20.下表中的实线表示元素周期表的部分边界。①一⑤分别表示元素周期表中对应位置的
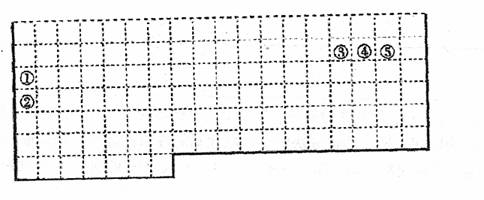 元素。
元素。
(1)请在上表中用实线补全元素周期表边界。
(2)元素③氢化物的电子式为 ,元素①的最高价氧化物对应水化物的电子式为 。
(3)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等。
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置。
②甲、乙两元素中金属性较强的是 (填名称),可以验证该结论的实验是 。
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将除掉表面氧化膜的这两种元素的单质分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的热稳定性
(4)写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式
19.某些废旧塑料可采用下列方法处理:将废塑料隔绝空气加强热,使其变成有用的物质,实验装置如右图。
|
产物 |
氢气 |
甲烷 |
乙烯 |
丙烯 |
苯 |
甲苯 |
碳 |
|
质量分数(%) |
12 |
24 |
12 |
16 |
20 |
10 |
6 |

加热聚丙烯废塑料得到的产物如右上表:
(1)试管A中残余物有多种用途,如下列转化就可制取高聚物聚乙炔。
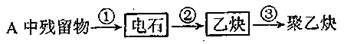
写出反应③的化学方程式 。
(2)试管B收集到的产品中,能使酸性高锰酸钾溶液褪色的物质,其一氯代物有
种。
(3)锥形瓶C中观察到的现象 。
经溴水充分吸收,剩余气体经干燥后的平均相对分子质量为 。
(4)写出C中逸出的气体在工业上的两种用途 、 。
17.(1)写出下列微粒的名称。
①一OH ②-CHO ③OH-
(2)下列各组中的两种有机物,可能是相同的物质、同系物或同分异构体等,请判断它们之间的关系。
①2一甲基丁烷和丁烷 ②异戊烷和2,2一二甲基丙烷
③间二甲苯和乙苯 ④1-己烯和环己烷
(3)下列物质①铁 ②干冰③金刚石④铜⑤水品⑥氯化钠⑦碘⑧氢氧化钠中熔化或溶于水时克服离子键的是 ,(填写序号,下同)熔化时克服共价键的是 ,溶于水克服分子问作用力的是 。
(4)在烃的分子结构中,若每减少2个氢原子,则相当于碳碳间增加l对共用电子。试回答下列问题:
①分子式为CnH2n+2的烷烃中碳碳原子间共用电予对数为
②分子式为CnH2n-6的链烃分子中碳碳原子问共用电子对数为
③CX可看作足烃减氢后的产物,若某物质分子中碳碳原子间共用电子对数为140,则符,合该条件的碳单质的化学式为 ;符合该条件的稀烃的分子式是 。
 18.汽油不仅是最重要的燃制,而且是重要的化工原料,它既可裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原判的下列衍变关系,写出相应的化学方程式(有机物写结构简式),在括弧中填反应类型。
18.汽油不仅是最重要的燃制,而且是重要的化工原料,它既可裂解得到气态化工原料如乙烯等,还可以在催化剂催化下改变分子结构,由链烃变成芳香烃,如已烷变成苯,庚烷变成甲苯,这个变化叫异构化。请根据以汽油为原判的下列衍变关系,写出相应的化学方程式(有机物写结构简式),在括弧中填反应类型。
(1)
(2)
(4)
信息提示:苯环上原有取代基对新导入苯环上的取代基的位置有一定影响,其规律是:①苯环上新导入的取代基所占的位置决定于原取代基的性质;
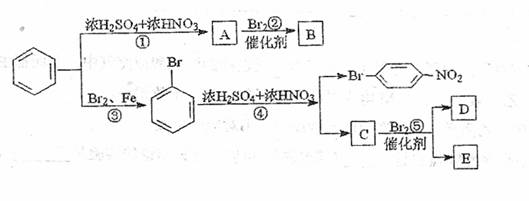 ②可以把原取代基分为二类:第一类是邻对位取代基,如-OH、-C1、-Br、-R、-OCOR…,可使新的取代基进入苯环的邻位或对位;第二类是间位取代基,如-NO2、-SO3H、-CHO、-COOH…,可使新的取代基进入苯环的间位,分析下列变化:
②可以把原取代基分为二类:第一类是邻对位取代基,如-OH、-C1、-Br、-R、-OCOR…,可使新的取代基进入苯环的邻位或对位;第二类是间位取代基,如-NO2、-SO3H、-CHO、-COOH…,可使新的取代基进入苯环的间位,分析下列变化:
(1)C的结构简式为 ;
(2)D与E互为同分异构体,D的结构简式为 ;
(3)写出上图中②反应的化学方程式 。
16.有X、Y两种元素,原子序数≤20,X的原子半径小于Y,且X、Y原子的最外层电子数相同(选项中m、n均为正整数)。下列说法正确的是 ( )
A.若X(OH)n为强碱,则y(OH)。也一定为强碱
B.若HnXOm为强酸,则X的氢化物溶于水一定显酸性
C.若X元素形成的单质是X2,则Y元素形成的单质一定是Y2
D.若Y的最高正价为+m,则X的最高正价一定为+m
15.含有2-5个碳原子的直链烷烃沸点和燃烧热的数据见下表
|
烷烃名称 |
乙烷 |
丙烷 |
丁烷 |
戊烷 |
|
沸点(℃) |
-88.6 |
-42.1 |
-0.5 |
36.1 |
|
*燃烧热(kJ/mo1) |
1560.7 |
2219.2 |
2877.6 |
3535.6 |
*燃烧热:1摩尔物质完全燃烧,生成二氧化碳、液态水时所放出的热量。
根据表中数据,下列判断错误的是 ( )
A.正庚烷在常温常压下肯定不是气体
B.烷烃燃烧热和其所含碳原子数成线性关系
C.随碳原子数增加,烷烃沸点逐渐升高
D.随碳原子数增加,烷烃沸点和燃烧热都成比例增加
14.下列说法中错误的是 ( )
A.原子及其离子的核外电子层数等于该元素所在的周期数
B.元素周期表中从IIIB族到IIB族10个纵行的元素都是金属元素
C.除氨外的稀有气体原子的最外层电子数部是8
D.同一元素的各种同位素的物理性质、化学性质均相同
13.下列说法正确的是(NA表示阿伏加德罗常数的值)
A.标准状况下,1L甲烷和IL氯气光照反应后混合物体积为2L,所含分子数为l/22.4NA
B.标准状况下,1L辛烷完全燃烧后,所生成气态产物的分子数为8/224NA
C.1 mol辛烷分子中共价键的数目为25NA
D.1mol-CH3带l mol负电荷,所含电子数为9 NA
11.由一氧化碳、甲烷和乙烷组成的混合气体8.96 L(标准状况),在足量氧气中充分燃烧后,生成气体先通过足量浓硫酸.再通过足量氢氧化钠溶液,若氢氧化钠溶液增重26 4g,则原混合气体中乙烷的物质的量为 ( )
A.等于0.1 mo1 B.大于或等于0.2mol,小于0.3tool
C.等于0.2mol D.大于0.1mol小于0.3mol
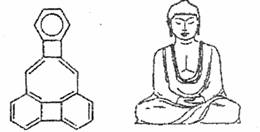 12.美国康乃尔大学的魏考克斯(c Wilcox)
12.美国康乃尔大学的魏考克斯(c Wilcox)
所台成的一种有机分子,就像一尊释迦
牟尼佛。因而称为释迦牟尼分子(所有
原子在同一平面)。有关该有机分子的
说法不正确的是 ( )
A.该有机物属于芳香烃
B.该有机物属于苯的同系物
C.该有机物分子中含有22个碳原子
D.该有机物的一氯代物只有3种
10.在下列有关晶体的叙述中错误的是 ( )
A.离子晶体的构成微粒是离子,所以离子品体中只含离子键
B.原子晶体的熔沸点一般很高
C.金属晶体的熔沸点均很高
D.稀有气体的原予能形成分子晶体
9.下列叙述正确的是 ( )
A.乙烯的结构简式为:CH2一CH2
B.石英的化学式为:CaSiO3
 C.在CS2、PCI3中各原子最外层均能达到8电子的稳定结构
C.在CS2、PCI3中各原子最外层均能达到8电子的稳定结构
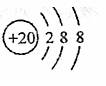
D. Ar原子的结构示意图为:
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com