
6、浓硫酸的作用是什么? 催化剂:提高反应速率;
吸水性:浓硫酸可以吸收生成物中的水,使反应向正反应方向进行.
5、药品的添加顺序如何?
在试管中加入3 mL乙醇,然后边摇动试管边慢慢加入2 mL 浓硫酸和2 mL 乙酸。
4、不加热反应能够发生么?加热的目的是什么?
提高反应速率;使生成的乙酸乙酯挥发,有利于收集乙酸乙酯。
3、试管为什么要倾斜加热? 增大受热面积
2、加碎瓷片的作用是什么? 防止暴沸
4.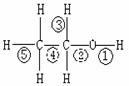 乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中断裂键的说法不正确的是( )
乙醇分子中不同的化学键,如右图:关于乙醇在各种反应中断裂键的说法不正确的是( )
A.乙醇和钠反应,键①断裂
B.在铜催化下和O2反应,键①③断裂
C.乙醇完全燃烧时键①②断裂。
D.在铜催化下和O2反应,键①②断裂
﹡5.已知:(1)醇类物质在催化剂存在条件下可发生类似于乙醇的脱氢氧化。(2)羰基(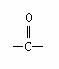 )与两个烃基相连构成的化合物 叫酮(如丙酮
)与两个烃基相连构成的化合物 叫酮(如丙酮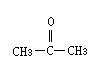 );而分别与烃基和氢相连构成的化合物叫醛(如乙醛CH3CHO)。下列醇被氧化时,不可能得到醛类化合物的是 ( )
);而分别与烃基和氢相连构成的化合物叫醛(如乙醛CH3CHO)。下列醇被氧化时,不可能得到醛类化合物的是 ( )
A.(CH3)3COH B.CH3CHOHCH3 C.CH3CH2CH2OH D.(CH3)3CCH2OH
教 案
|
课题:第三章 第三节 生活中两种常见的有机物(2) --- 乙酸 |
授课班级 |
|
|
课 时 |
1 |
|
|
教 学 目 的 |
知识 与 技能 |
1、了解乙醇的分子式和结构式,理解羧基的结构特点; 2、理解酯化反应的概念;掌握乙醇的酸性和酯化反应等化学性质 3、能够初步熟悉乙酸的酯化反应实验的有关操作 |
|
过程 与 方法 |
1、通过展示乙酸分子的球棍模型及实物,进一步认识乙酸的分子式结构及其物理性质 2、采用复习回忆法及实验验证法学习乙酸的酸性 3、利用实验探究、设疑引导学生学习乙酸的酯化反应,明确酯化反应的实质 |
|
|
情感 态度 价值观 |
1、培养学生的观察能力,分析归纳思维能力 2、能够通过乙醇用途等的学习,认识化学与生产生活的密切联系,从而激发学习化学的兴趣,提高学习化学的积极性 |
|
|
重 点 |
乙酸的酸性和乙酸的酯化反应 |
|
|
难 点 |
乙酸酯化反应的实质 |
|
|
知 识 结 构 与 板 书 设 计 |
第三节 生活中两种常见的有机物--乙酸 一、物理性质 1.无色有强烈刺激性气味的液体 2.易溶于水乙醇等溶剂 3.沸点:117.9℃,易挥发;熔点:16.6℃ ,易结晶,又称冰醋酸 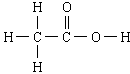 二、分子组成与结构 二、分子组成与结构1、化学式:C2H4O2 2、结构式: 3、结构简式:CH3COOH 4、官能团:羧基 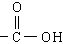 (-COOH) (-COOH)三、化学性质 1﹑乙酸是一种有机弱酸,具有酸的通性。 酸性强弱:H2SO4 > CH3COOH > H2CO3 2﹑酯化反应: (1) 定义:酸跟醇作用生成酯和水的反应叫酯化反应。 (2) 实质:酸脱羟基、醇脱氢(羟基上的)  (3)特点:是可逆反应,反应物不能完全转化成生成物;反应比较慢,一般要加入浓硫酸作催化剂,并加热。 四、乙酸的工业制法与用途---乙醛催化氧化制乙酸 五、酯 1、定义:酸和醇发生酯化反应得到的有机物;羧酸和醇反应得到的酯称为羧酸酯。 2、存在:低级酯存在于各种水果和花草中,具有芳香气味的液体 3、物理性质:密度一般小于水,并难溶于水(乙酸乙酯微溶),易溶于乙醇和乙醚等有机溶剂。 4、用途:可用溶剂,也可用制备饮料和糖果的香料。 5、化学性质---酯的水解 |
|
|
教学过程 |
||
|
教学步骤、内容 |
教学方法、手段、师生活动 |
|
|
[引课]两幅漫画:1、煮排骨时放点醋可以补钙,2、喝醉酒可以用醋解 [思考与交流]1、他们都用到了什么物质? 2、醋的主要成分是什么? 3、这两组漫画有无科学根据? [讲述]俗话说:“百姓出门七件事:柴、米、油、盐、酱、醋、茶”其中说到的醋的主要成分就是乙酸,所以乙酸又叫醋酸。下面我们就来学习乙酸的结构和性质。 [板书] 第三节 生活中两种常见的有机物--乙酸 [讲]醋的来历: 传说古代山西省有个酿酒高手叫杜康。他儿子黑塔跟父亲也学会了酿酒技术。后来,从山西迁到镇江。黑塔觉得酿酒后把酒糟扔掉可惜,把酒糟浸泡在水缸里。到了第二十一日的酉时,一开缸,一股浓郁的香气扑鼻而来。黑塔忍不住尝了一口,酸酸的,味道很美。烧菜时放了一些,味道特别鲜美,便贮藏着作为“调味酱”。故醋在古代又叫“苦酒” [展示]无水乙酸样品,让学生观察并总结乙酸的物理性质(颜色、状态和气味)。 [板书]一、物理性质 1.无色有强烈刺激性气味的液体 2.易溶于水乙醇等溶剂 3.沸点:117.9℃,易挥发;熔点:16.6℃ ,易结晶,又称冰醋酸 [讲]当温度低于16.6℃时无水乙酸易凝结成冰一样的晶体,所以无水乙酸又称为冰醋酸。 [过渡]刚才我们已经了解了乙酸的一些外观特征,那么乙酸分子的内部结构又是怎么样的呢?我们来看看乙酸分子的结构模型。 [展示]乙酸分子的球棍模型,让学生总结乙酸的化学式、结构式和结构简式。  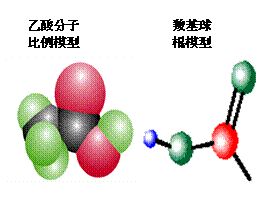 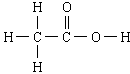 [板书]二、分子组成与结构 [板书]二、分子组成与结构1、化学式:C2H4O2 2、结构式: 3、结构简式:CH3COOH 4、官能团:羧基 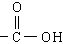 (-COOH) (-COOH)[讲]乙酸可以看作是甲基和羧基组成的。羧基是由羟基跟羰基共同组成的。其性质是由两个基团互相影响共同决定的, [投影分析] 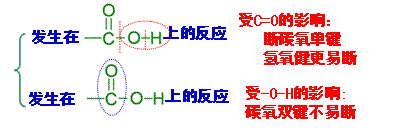 [过]那么接下来我们通过几个小实验来研究一下乙酸有哪些化学性质。 [板书]三、化学性质 [问]根据初中已学知识,大家说说乙酸有什么性质? 弱酸性 [师]根据下列药品,设计实验证明乙酸的确有酸性 药品:镁条、NaOH溶液、Na2CO3粉末、乙酸溶液、酚酞 [实验一] 乙酸与镁的反应 实验步骤:向一支盛有少量乙酸的试管里加入一小段镁条,观察现象。 实验现象:有气泡产生 实验结论:乙酸能跟活泼金属作用,具有酸性。 化学反应方程式:2CH3COOH + Mg == Mg(CH3COO)2 +H2 ↑ [实验二] 乙酸与碳酸钠的反应 实验步骤:向一盛有少量碳酸钠粉末的试管里,加入约3mL乙酸溶液,观察现象。 实验现象:试管里有无色、无味的气泡生成 实验结论:乙酸具有酸性,且酸性比碳酸的酸性强。 相关化学反应方程式: 2CH3COOH + Na2CO3= 2CH3COONa + CO2 ↑+ H2O [实验三]乙酸和氢氧化钠反应 实验步骤:先取氢氧化钠溶液于试管中,加入一滴酚酞,再逐滴加入乙酸 实验现象:红色褪去 实验结论:乙酸具有酸性 化学方程式:CH3COOH + NaOH = CH3COONa +H2O [归纳]通过前面几个小实验可以证明乙酸具有酸的通性:能与活泼金属、碱、盐等物质发生反应。乙酸的酸性比硫酸、盐酸等的酸性弱,但比碳酸的酸性强。 [投影小结]  [科学探究]设计一个实验,比较醋酸和碳酸的酸性强弱. 利用乙酸与Na 2CO3的反应。这说明乙酸的酸性强于碳酸。尽管如此,但它在水溶液里还是只能发生部分电离,仍是一种弱酸。 [思考与交流]观看“除去水垢”漫画,说出其中的道理。 [投影]乙酸除去水垢的原理: 2CH3COOH + CaCO3 = (CH3COO)2 Ca +H2O+CO2↑ [板书] 1﹑乙酸是一种有机弱酸,具有酸的通性。 酸性强弱:H2SO4 > CH3COOH > H2CO3 [过]乙酸除了具有酸的通性外,还有什么其他化学性质呢? 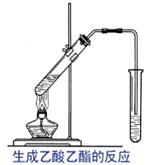 [演示实验] 乙酸与乙醇的反应 [演示实验] 乙酸与乙醇的反应实验步骤:在试管里先加入3mL无水乙醇,然后一边摇动一边慢慢地加入2mL浓硫酸和2mL无水乙酸。然后用酒精灯小心均匀地加热试管3~5min。同时将导管通到装有饱和碳酸钠溶液的试管中,观察现象,注意产物的气味。 实验现象:有不溶于水,具有果香味的无色透明油状液体生成
CH3COOH + CH3CH2OH CH3COOCH2CH3 + H2O [讲]通过实验得出:乙酸与乙醇在有浓硫酸存在并加热的条件可以发生反应,实验中生成的有果香味的无色透明油状液体叫乙酸乙酯。像这种酸跟醇作用生成酯和水的反应叫酯化反应。乙酸与乙醇的酯化反应是可逆的。 [板书]2﹑酯化反应: (1) 定义:酸跟醇作用生成酯和水的反应叫酯化反应。 [问]在酯化反应中乙酸和乙醇有几种可能的断键方式?如何确定实际发生的是哪种断键方式? [投影]两种可能的断键情况
[动画演示]利用同位素原子示踪法验证酯化反应的实质 [板书](2) 实质:酸脱羟基、醇脱氢(羟基上的)
(3)特点:是可逆反应,反应物不能完全转化成生成物。 反应比较慢,一般要加入浓硫酸作催化剂,并加热。 [思考与交流]1、酯化反应属于哪种基本反应类型? 酯化反应属于取代反应中的一种,也可看作是分子间脱水的反应。 3.乙醇结构与性质方面的说法中正确的是( ) A.乙醇结构中有-OH,所以乙醇溶解于水,可以电离出OH-而显碱性 B.乙醇中的羟基可以和钠反应,同样也可以和氢氧化钠溶液反应 C.乙醇与钠反应可以产生氢气,所以乙醇显酸性 D.乙醇与钠反应非常平缓,所以乙醇羟基上的氢原子不如水中的氢原子活泼 2.能证明乙醇分子中含有一个羟基的事实是( ) A.乙醇完全燃烧生成水 B.0.1mol乙醇与足量金属钠反应生成0.05molH2 C.乙醇能与水以任意比例互溶 D.乙醇容易挥发 1.下列有关乙醇的物理性质的应用中不正确的是 ( ) A.由于乙醇的密度比水小,所以乙醇中的水可以通过分液的方法除去 B.由于乙醇能够溶解很多有机物和无机物,所以可用乙醇提取中药的有效成分 C.由于乙醇能够以任意比溶解于水,所以酒厂可以勾兑各种浓度的酒 D.由于乙醇容易挥发,所以才有熟语“酒香不怕巷子深”的说法 3、在有机化学中常用反应物的得氧或得氢来判断氧化还原反应。有机物得氧或失氢的反应叫做氧化反应;有机物得氢或失氧的反应叫做还原反应。 [思考与交流]铜丝放在酒精灯外焰灼烧,慢慢移向内焰,上下几次。观察铜丝的变化。 红-黑-红 [讲]乙醇能使酸性高锰酸钾和重铬酸钾褪色,乙醇被直接氧化生成乙酸 [板书](3) 直接氧化-生成乙酸 [知识拓展]醇催化氧化的规律: ①与羟基(-OH)相连碳原子上有两个氢原子的醇(-OH在碳链末端的醇),被氧化生成醛。 2R-CH2-CH2OH+O2
②与羟基(-OH)相连碳原子上有一个氢原子的醇(-OH在碳链中间的醇),被氧化生成酮。
③与羟基(-OH)相连碳原子上没有氢原子的醇不能被催化氧化。
[过]请大家回忆实验室制乙烯的方法,我们知道,乙醇在浓H2SO4作催化剂和脱水剂的条件下,加热到170℃即生成乙烯,该反应属于消去反应。因此乙醇还可以发生消去反应。 [板书]3、脱水 (1) 分子内脱水---消去反应-实验室制乙烯
[注意]①分子中至少有两个C原子,如CH3OH就不能发生消去反应; ②羟基所连C原子的相邻C上要有H原子,否则不能发生消去反应。 [讲]消去反应是从一个分子内脱去一个小分子而形成不饱和化合物的反应。如将该反应的温度控制在140℃,则发生分子间脱水生成乙醚 [板书](2) 分子间脱水-取代反应 CH3CH2OH+HOCH2CH3 [讲]乙醚是醚类中最重要的一种。凡是两个烃基通过一个氧原子连结起来的化合物叫做醚。醚的通式是R-O-R',R和R'都是烃基,可以相同,也可以不同。乙醚是一种无色易挥发的液体,沸点是4.51 ℃,有特殊的气味。吸入一定量的乙醚蒸气,会引起全身麻醉,所以纯乙醚可用作外科手术时的麻醉剂。乙醚微溶于水,易溶于有机溶剂,它本身是一种优良溶剂,能溶解许多有机物。乙醚蒸气很容易着火,空气中如果混有一定比的乙醚蒸气,遇火就会发生爆炸,所以使用乙醚时要特别小心。 [知识拓展]实验室常用固体NaBr、浓H2SO4和乙醇共热来制取溴乙烷,这利用的是乙醇与卤代烃的取代反应。该反应中断的是C-OH键。 [板书]4、与氢卤酸反应--- 取代反应 C2H5OH+HBr
[投影小结]乙醇结构与性质关系
[过]乙醇在生产、生活中的用途十分广泛,用量也很大,下面让我们来一起研究一下乙醇的工业制法 [板书]四、乙醇的工业制法 [讲]我国劳动人民早在几千年前就掌握了发酵酿酒术,至今,发酵法仍是制备乙醇的重要方法。发酵法以富含淀粉的各种谷物和野生果实为原料,经下列过程成为发酵液:
发酵液内含乙醇10%-15%,发酵液经蒸馏可得含95.6%的乙醇和4.4%水的恒沸液液,称为工业酒精。 [板书]
[知识拓展]
[总结]
[自我评价] 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |