
7.(08年广东化学·11)下列化学反应的离子方程式正确的是A
A.在稀氨水中通入过量CO2:NH3·H2O+CO2=NH4++HCO3-
B.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
C.用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑
D.氢氧化钙溶液与等物质的量的稀硫酸混合:Ca2++OH-+H++SO42-=CaSO4↓+H2O
答案:A
解析:HClO有强氧化性,可把SO32-氧化为SO42-,B错。稀HNO3有氧化性,可把S2-与Fe2+氧化,应为FeS+4HNO3=Fe(NO3)3+S↓+NO+H20(还有可能生成SO2,SO3) C错。D应为Ca2++ 2OH- +2H+ + SO42- ==CaSO4↓ + 2H2O,所以D错。
6.(2007海南·12)有BaCl2和NaCl的混合溶液aL,将它均分成两份。一份滴加稀硫酸,使Ba2+离子完全沉淀;另一份滴加AgNO3溶液,使Cl 离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
离子完全沉淀。反应中消耗xmol H2SO4、ymol AgNO3。据此得知原混合溶液中的c(Na+)/ mol·L-1为( )
A.(y-2x)/a B.(y-x)/a C.(2y-2x)/a D.(2y-4x)/a
答案:D
考点:本题考查了物质的量的相关计算。
解析:本题的解题关键是将溶液分成两份,即每份体积为a/2 L ,n(Ba2+)=n (H2SO4)=xmol,n(Cl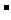 )=n( AgNO3)=ymol,根据电荷守恒
)=n( AgNO3)=ymol,根据电荷守恒
2x[Ba2+]+[Na+]=[Cl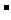 ],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl
],在同一溶液中得:2 x n(Ba2+) +n(Na+)=n(Cl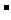 )。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
)。N( Na+)=y-2xmol,所以c[Na+]为(y-2x)/2a 即(2y-4x)/a
。
5.(2007海南·11)在pH=1时,可大量共存且形成无色溶液的一组离子或分子是( )
A.Ca2+、CH3COOH、Br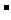 、Na+ B.NO
、Na+ B.NO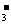 、Fe3+、Mg2+、SO
、Fe3+、Mg2+、SO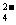
C.HClO、Ba2+、Na+ 、Cl D.K+、Cl
D.K+、Cl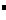 、Al3+、SO
、Al3+、SO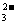
答案:A
考点:本题考查了离子共存问题。
解析:pH=1时,溶液显强酸性,OH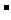 与弱酸根离子都不能共存。所以,D错。B中存在棕黄色的Fe3+,C中HClO与Cl
与弱酸根离子都不能共存。所以,D错。B中存在棕黄色的Fe3+,C中HClO与Cl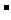 发生氧化还原反应。所以选A。
发生氧化还原反应。所以选A。
4.(2007海南·10)能正确表示下列反应的离子方程式是( )
A.碳酸氢钙溶液和氢氧化钠溶液混合:HCO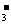 +OH
+OH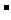 ==CO
==CO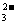 +H2O
+H2O
B.醋酸钠溶液和盐酸混合:CH3COONa+H+ == CH3COOH + Na+
C.少量金属钠放入冷水中:Na+ 2H2O== Na++2OH-+H2↑
D.硫酸铜溶液和氢氧化钡溶液混合:Cu2+ +
SO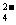 +Ba2+ + 2OH
+Ba2+ + 2OH == Cu(OH)2↓+ BaSO4↓
== Cu(OH)2↓+ BaSO4↓
答案:D
考点:本题考查了离子方程式的正误判断。
解析:离子方程式的正误判断是必考考点,A中产物应有CaCO3沉淀生成;B中CH3COONa为可溶性盐应拆成离子形式;C电荷不守恒。
3.(07年广东理基·36)下列反应的离子方程式正确的是
A.向Ba(OH)2溶液中滴加稀盐酸: 2H++2Cl-+Ba2++2OH- 2H2O+BaCl2
B.往FeCl3溶液中加入Fe粉:2Fe3++Fe 3Fe2+
C.往澄清石灰水中通入过量二氧化碳: Ca2++2OH-+CO2 CaCO3↓+H2O
D.往FeCl3溶液中加入Cu粉:Fe3++Cu Fe2++Cu2+
答案:B
解析:A选项中的BaCl2为易溶于水的强电解质,应写成离子的形式,故错误;C选项中的二氧化碳是过量的应生成可溶性的Ca(HCO3)2,故错误;D选项中的反应电荷不守恒故错误。因此正确的离子方程式为B选项。
2.(07年广东化学·11)下列化学反应的离子方程式正确的是
A.用小苏打治疗胃酸过多:HCO3-+H+=CO2↑+H2O
B.往碳酸镁中滴加稀盐酸:CO32-+2H+=CO2↑+H2O
C.往氨水中滴加氯化铝:Al3++4OH-=AlO2-+2H2O
D.氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-=BaSO4↓+H2O
答案:A
解析:离子方程式正误判断主要抓住二个原则,一是符号书写是正确,包括:①原理是否正确②化学式与离子形式拆合是否正确,二是是否守恒。包括:①电荷守恒②电子转移守恒③原子守恒。 题中B选项碳酸镁为难溶物应写化学式,C选项氨水不能使氢氧化铝溶解,D选项应为:Ba2++SO42-+2H++2OH-=BaSO4↓+2H2O。
1.(07年宁夏理综·11)下列反应的离子方程式正确的是
A.锌片插入硝酸银溶液中:Zn+Ag+=Zn2++Ag
B.碳酸氢钙溶液加到醋酸中:Ca(HCO3)2+2CH3COOH=Ca2++2CH3COO-+2CO2↑+2H2O
C.少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑
D.氢氧化铜加到盐酸中:Cu(OH)2+2H+=Cu2++2H2O
答案:D
解析:A选中的例子方程式电荷不守恒,正确的例子方程式应为Zn+2Ag+=Zn2++2Ag;B选项中的Ca(HCO3)2为可溶性盐,应写为离子符号,正确的离子方程式应为HCO3-+CH3COOH=+CH3COO-+CO2↑+H2O;C选项中的离子方程式质量不守恒,正确的离子方程式应为2Na+2H2O=2Na++2OH-+H2↑;D选项中的离子方程式符合书写要求,是正确的。
1.(07年山东理综·12)下列叙述正确的是
A.16 8O2和18 8O2互为同位素,性质相似
B.常温下,pH=1的水溶液中Na+、NO3-、HCO3-、Fe2+可以大量共存
C.明矾和漂白粉常用于自来水的净化和杀菌消毒,两者的作用原理相同
D.C(石墨,s)=C(金刚石,s) △H>0,所以石墨比金刚石稳定
答案:D
解析:A选项中同位素是指中子数不同、质子数相同的不同核素(原子)的互称,选项中给出的是分子,错误;B中PH=1的溶液为强酸性环境,解答时应在离子组Na+、NO3-、HCO3-、Fe2+ 中增加H+,分析可知碳酸氢根离子和氢离子不共存,在氢离子存在时硝酸根离子和亚铁离子不能共存,错误;C中明矾的净水原理是其溶于水电离产生的铝离子水解生成氢氧化铝能吸附水中悬浮物,而漂白粉是由其成分中的次氯酸钙和水、二氧化碳反应生成的次氯酸能杀菌消毒,作用原理不同,错误;D中此反应的△H>0,说明此反应是吸热反应,也就是金刚石的具有能量大于石墨,物质具有的能量越大,该物质越不稳定,正确。
2.海洋占地球表面积的3/4,它能对地球生态环境起调节作用,同时也蕴藏着丰富的物质资源。
(1)据测算,地球上的氧气90%来自于藻类植物的光合作用,而环境污染的加剧,使海洋表层的浮游植物大量死亡,从而进一步加剧温室效应,这是由于大量浮游植物的死亡会使大气中的 增加所致。
(2)我国首创的铝、空气、海水电池为能源的新型海水标志灯已研制成功。这种灯以海水为电解质,靠空气中的氧使铝不断氧化而产生电流。上述新型电池 为负极。 2、(1)CO2 (2)Al
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com