
8.(2009·湖北荆州质检二·8)已知直线x+y+m=0与圆x2+y2=2交于不同的两点A、B,O是坐标原点,|+|≥||,那么实数m的取值范围是( )
A.(-2,-]∪[,2) B.(-2,2)
C.[-,] D.(-2,]
答案:A
解析:由|+|≥=|-|得|+|2≥|-|2,·≥0,0<∠AOB≤,三角形AOB为等腰直角三角形或顶角为锐角的等腰三角形,圆心到直线的距离1≤d<,1≤<,那么实数m的取值范围是(-2,-]∪[,2).故选A.
7.(2009·河南实验中学3月)若直线l:ax+by=1与圆C:x2+y2=1有两个不同交点,则点P(a,b)与圆C的位置关系是( )
A.点在圆上 B.点在圆内
C.点在圆外 D.不能确定
答案:C
解析:直线l:ax+by=1与圆C:x2+y2=1有两个不同交点,则<1,a2+b2>1,点P(a,b)在圆C外部,故选C.
6.(2009·安阳)已知直线x+y=a与圆x2+y2=4交于A、B两点,且|+|=|-|,其中O为原点,则实数a的值为( )
A.2 B.-2
C.2或-2 D.或-
答案:C
解析:由|+|=|-|得|+|2=|-|2,·=0,⊥,三角形AOB为等腰直角三角形,圆心到直线的距离为,=,a=±2,故选C.
5.(2009·西城4月)与直线x-y-4=0和圆x2+y2+2x-2y=0都相切的半径最小的圆的方程是( )
A.(x+1)2+(y+1)2=2 B.(x+1)2+(y+1)2=4
C.(x-1)2+(y+1)2=2 D.(x-1)2+(y+1)=4
答案:C
解析:圆x2+y2+2x-2y=0的圆心为(-1,1),半径为,过圆心(-1,1)与直线x-y-4=0垂直的直线方程为x+y=0,所求圆的圆心在此直线上,排除A、B,圆心(-1,1)到直线x-y-4=0的距离为=3,则所求圆的半径为,故选C.
4.(2009·石家庄一模)过圆x2+y2=1上一点P作切线与x轴,y轴的正半轴交于A、B两点,则|AB|的最小值为( )
A.2 B.3 C. D.
答案:A
解析:设切线方程为+=1(a>0,b>0),则圆心到切线的距离=1,+=1,|AB|===≥2,故选A.
3.(2009·广西柳州三模)曲线C:(θ为参数)与直线x+y+a=0有公共点,那么实数a的取值范围是( )
A.(1,2) B.[0,1+]
C.[1-,1+] D.[-1,+1]
答案:C
解析:曲线C:即x2+(y+1)2=1与直线x+y+a=0有公共点,则圆心到直线的距离≤1,那么实数a的取值范围是[1-,1+],故选C.
2.(2009·广东重点中学)圆x2+y2+2x-4y+1=0关于直线2ax-by+2=0(a,b∈R)对称,则ab的取值范围是( )
A. B.
C. D.
答案:A
解析:圆x2+y2+2x-4y+1=0关于直线2ax-by+2=0(a,b∈R)对称,则圆心在直线上,求得a+b=1,ab=a(1-a)=-a2+a=-2+≤,ab的取值范围是,故选A.
1.(2009·陕西师大附中二模)在圆x2+y2=5x内,过点有n条弦的长度成等差数列,最小弦长为数列的首项a1,最长的弦为an,其中公差d∈,那么n的集合是( )
A.{3,4,5} B.{4,5,6}
C.{3,4,5,6} D.{4,5,6,7}
答案:D
解析:圆x2+y2=5x的圆心为,半径,过点有n条弦的长度成等差数列,最小弦长为数列的首项a1,它等于与过的直径垂直的弦的长度,则a1=2=4,最长的弦长为an,它的长度为直径,则an=5,d==,又公差d∈,则≤≤,4≤n≤7,n的集合是{4,5,6,7},故选D.
3.(09年广东化学·23) 磷单质及其化合物的、有广泛应用。
(1)同磷灰石[主要成分]在高温下制备黄磷(P4)的热化学方程式为:
4Ca5(PO4)3F(s)+21SiO2(s)+30C(s)=3P4(g)+20CaSiO3(s)+30CO(g)+SiF4(g)
; H
H
①上述反应中,副产物矿渣可用来 。
②已知相同条件下:
4Ca3(PO4)2F(s)+3SiO2(s)=6Cas3(PO4)2(s)+2CaSio3(s)+SiF4(g) ;△H1
2Ca3(PO4)2(s)+10C(s)=P4(g)+6CaO(s)+10CO(g);△H2
SiO2(s)+CaO(s)=CaSiO3(s) ;△H3
 用△H1、△H2和△H3表示
用△H1、△H2和△H3表示 H,
H, H=
。
H=
。
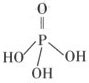
(2)三聚磷酸可视为三个磷酸分子(磷酸结构式见右图)之间脱去两个水分子产物,其结构式为 。三聚磷酸钠(俗称“五钠”)是常用的水处理剂,其化学式为 。
(3)次磷酸钠(NaH2PO2)可用于化学镀镍。
①NaH2PO2中P元素的化合价为 。
②化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性等条件下发生下述反应:
(a) Ni2+ + H2PO2-+ → Ni++ H2PO3-+
(b)6H2PO-2 +2H+ =2P+4H2PO3+3H2↑
请在答题卡上写出并配平反应式(a)。
③利用②中反应可在塑料镀件表面沉积镍-磷合金,从而达到化学镀镍的目的,这是一种常见的化学镀。请从以下方面比较化学镀与电镀。
方法上的不同点: ;原理上的不同点: ;化学镀的优点: 。
[答案](1)水泥;△H1-3△H2+18△H3(2)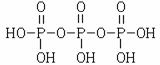 ,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
,Na5P3O10,(3)+1;2Ni2+
+ 1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+(4)化学镀中镀件直接与电解质溶液接触反应;电镀通过外加电流,在镀件外形成镀层 ;化学镀是利用化学腐蚀反应;电镀是利用电解池,外加电流进行氧化还原反应 ; 装置简便,节约能源,操作简便 。
[解析](1)①由方程式可以看出副产物矿渣应该是CaSiO3(s),结合炼铁我们不难得出答案是制水泥21世纪教育网
②运用盖斯定律,反应1-反应2×3+反应3×18=总反应,则△H=△H1-3△H2+18△H3
(2)结合题意三聚磷酸钠(俗称“五钠”)可知产物三聚磷酸应含有五个羟基,即三个
磷酸分子之间有三个羟基相互反应脱去两个水分子,所以三聚磷酸的结构式为
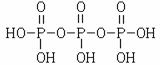 ,三聚磷酸钠的化学式为Na5P3O10。
,三聚磷酸钠的化学式为Na5P3O10。
(3)①因为Na、H的化合价为+1,O为-2,所以由化合价代数和为0可得P的化合价为:+1。
②由得失电子数目守恒(2-1)×2=(3-1)×1,可知Ni2+ 和Ni+的化学计量数为2,H2PO2-和H2PO3-的化学计量数为1,再由电荷守恒2×2-1=2×1-1+2×1,可知H+在方程式的右边,H2O在方程式的左边,化学计量数分别为2和1。即总方程式为:2Ni2+ +1H2PO2-+ 1H2O → 2 Ni+ +1H2PO3-+ 2 H+
③比较化学镀与电镀应该从反应环境和条件以及反应实质和产物方面去分析归纳问题,从方法上分析,电镀是利用电解原理通过外加直流电源,在镀件表面形成的镀层,镀层一般只有镍,而化学镀是利用氧化还原反应镀件直接与电解质溶液接触,在塑料镀件表面沉积镍-磷合金,这是两者的不同;从原理上分析,无论电镀还是化学镀均有电子的转移,均是利用了氧化还原反应,这是两者的相同点,不同点是化学镀用的是化学反应,而电镀用的是电化学;很明显化学镀装置简单,而且不需要消耗电能,装置简单、耗能少、操作简便应该是化学镀优于电镀的21世纪教育网
[考点分析]有关化学反应热的综合应用题。
21世纪教育网
2. 北京奥运会“祥云”火炬燃料是丙烷(C3H8),亚特兰大奥运会火炬燃料是丙烯(C3H6)。
(1)丙烷脱氢可得丙烯。
已知:C3H8(g)=CH4(g)+HC
 CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH(g)+H2(g) △H1=156.6
kJ·mol-1
CH3CH
 CH2(g)=CH4(g)+HC
CH2(g)=CH4(g)+HC
 CH(g ) △H2=32.4 kJ·mol-1
CH(g ) △H2=32.4 kJ·mol-1
则相同条件下,反应C3H8(g)=CH3CH
 CH2(g)+H2(g) 的△H= kJ·mol-1。
CH2(g)+H2(g) 的△H= kJ·mol-1。
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐。电池反应方程式为 ;放电时CO32-移向电池的 (填“正”或“负”)极。
(3)碳氢化合物完全燃烧生成CO2和H2O。常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5
mol·L-1。若忽略水的电离及H2CO3的第二级电离,则H2CO3 HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
HCO3-+H+的平衡常数K1=
。(已知10-5.60=2.5×10-6)
(4)常温下,0.1 mol·L-1NaHCO3溶液的pH大于8,则溶液中c(H2CO3) c(CO32-)(填“>”、“=”或“<”),原因是 (用离子方程式和必要的文字说明)21世纪教育网
[答案]
(1)124.2
(2)C3H8+5O2=3CO2+4H2O 负
(3)4.2×10-7 mol·L-1
(4)> HCO3-+H2O=CO32-+H3O+(或HCO3-=CO32-+H+)、HCO3-+H2O=H2CO3+OH-,HCO3-的水解程度大于电离程度
[解析](1)将第2个方程式颠倒反写,然后与第1个方程式相加,即得所求的反应C3H8(g)====CH3CH=CH2 (g)+H2(g),△H也随方程式的变化关系进行求算:△H=-△H2+△H1=124.2kJ.mol-1。
(2)以丙烷为燃料制作的新型燃料电池,其电池反应方程式为C3H8十502=3C02+4H20,因电子从电池的负极经导线流入了电池的正极,故电池的正极是电子富集的一极,故带负电荷的离子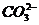 在电解质溶液中应移向电池的负极而不是正极21世纪教育网
在电解质溶液中应移向电池的负极而不是正极21世纪教育网
(3)根据电离平衡常数公式可知:
K1=c(H+)c(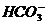 )/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol.
L-1。
)/c(H2CO3)=10-5.60×10-5.60/l.5×10-5=4.2×10-7mol.
L-1。
(4)0.1 mol L-1NaHCO3溶液的pH大于8,说明溶液呈碱性,即c((OH-)>c(H+),因在NaHCO3溶液中存在着两个平衡:电离平衡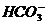 -
- CO32-+H+,水解平衡:
CO32-+H+,水解平衡: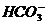 +H20
+H20  H2CO3+(OH- ,其余部分水的电离忽略不计,由c((OH-)>c(H+),说明水解过程大于电离过程,从而推出c(H2CO3)>c(
H2CO3+(OH- ,其余部分水的电离忽略不计,由c((OH-)>c(H+),说明水解过程大于电离过程,从而推出c(H2CO3)>c(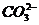 )21世纪教育网
)21世纪教育网
[考点分析]热化学方程式书写、电极方程式书写、电离平衡常数、溶液中离子浓度大小比较21世纪教育网
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com