
1、物理性质:纯硝酸无色,易挥发,有刺激性气味,熔沸点低,密度比水大。
4、归纳硝酸的物理、化学性质?
[归纳板书] 学生归纳,老师点评并板书
3、浓硝酸通常保存在棕色试剂瓶中,为什么?
2、通过实验探究,你对硝酸的氧化性有了哪些认识?
1、完成下列表格:
|
实 验 |
实 验
现 象 |
结 论 |
|
实验1 |
|
|
|
实验2 |
|
|
|
实验3 |
|
|
2、与碱溶液反应:NH4++OH- 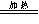 NH3 ↑+H2O
NH3 ↑+H2O
NH4++OH-= NH3·H2O
保存方法:密封、阴凉通风处保存。
施用注意事项:不能与碱性物质如草木灰等混用;埋在土下以保持肥效。
[课堂小结] 学生整合本节课所学的内容。
[课堂练习]教材P80-81 1(3)(4)(5)、4(1)
[课外作业]教材P81 2、3
第3课时
[复习引入] 通过前面的学习,你知道通过哪些方法可以制得NH3?如果实验室要制得少量NH3,你会选择哪种方法?为什么?(由于氮气与氢气反应条件不易获得,加热铵盐制得的NH3又不纯,故实验室选择铵盐与碱反应来制得少量氨气。)
[板书] 3、氨气的实验室制法。
|
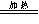 2 NH3
↑+CaCl2+2H2O
2 NH3
↑+CaCl2+2H2O
(2)发生装置--固体+固体→型
(3)干燥剂--碱石灰或无水CaCl2
(4)收集方法--向下排空气法
(5)验满方法--湿润的红色石蕊试纸
(6)尾气处理--用水吸收
<讨论>:用水吸收氨气时,可能会出现什么现象,如何防止这一现象的发生?
[讲述] 工业三酸之一的硝酸是一种重要的化工原料,也是一种重要的化学试剂,下面我们一起来讨论它的性质。
[板书] 五、硝酸及其应用
[实验1] 取一瓶浓硝酸,打开瓶盖,小心的扇闻浓硝酸的气味。
[实验2] 在两支试管中各放入一小块铜片,分别加入少量4mol/L的稀硝酸和14mol/L的浓硝酸,立即用蘸有氢氧化钠溶液的棉花封住试管口,观察试管中发生的现象。
[实验3] 将[实验2]中的金属铜换成金属铁进行相同的实验,观察发生的现象。
[交流讨论]用多媒体投影所要讨论的问题:
通过观察实验现象,思考并回答下列问题:
1、受热易分解:NH4Cl 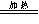 NH3 ↑+HCl↑
NH3 ↑+HCl↑
NH4HCO3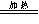 NH3
↑ +CO2
↑ +H2O
NH3
↑ +CO2
↑ +H2O
4、怎样合理地储存和施用铵态氮肥?
[归纳板书] 学生归纳,老师点评并板书
3、铵盐与碱溶液反应的本质是什么?
2、铵盐具有哪些物理、化学性质?
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com